用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
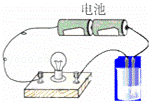
A.向亚硫酸钠溶液中通入氯气
B.向硝酸银溶液中通入少量氯化氢
C.向氢碘酸饱和溶液中通入少量氧气
D.向氢氧化钠溶液中通入少量氯气
答案
【考点】电解质溶液的导电性.
【专题】离子反应专题.
【分析】电解质溶液的导电性与离子浓度成正比,离子浓度越大,溶液导电性越强,溶液导电能力明显减弱说明溶液中离子浓度明显减小,据此分析解答.
【解答】解:A.向亚硫酸钠溶液中通入氯气,离子浓度增大,溶液导电能力明显增强,故A不选;
B.向硝酸银溶液中通入少量氯化氢反应生成AgCl和硝酸,溶液中离子浓度变化不明显,导致导电能力变化不明显,故B不选;
C.向氢碘酸饱和溶液中通入少量氧气,反应生成单质碘,溶液中离子浓度减小,所以溶液导电能力明显减弱,故C选;
D.向NaOH溶液中通入少量Cl2,NaOH是强电解质,生成的NaCl、NaClO也是强电解质,离子浓度变化不明显,溶液导电能力变化不明显,故D不选;
故选C.
【点评】本题考查电解质溶液导电性变化,电解质溶液导电性强弱与离子浓度成正比、与电荷成正比,与电解质强弱无关,题目难度不大.

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L