下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
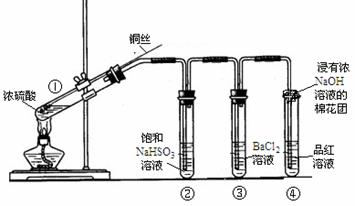
(1)①中反应的化学方程式是 。其中铜发生了 (填“氧化”或“还原”)反应,判断依据为 。
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是 。
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后![]() 将其中溶液分成两份做如下实验:
将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | ____________ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | ____________ |
完成上述反应的离子方程式。
(4)④中棉花团的作用是 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是 。
答案
【答案】(1)Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+ 2H2O;氧化;Cu失去电子生成了Cu2+;(2)a
CuSO4 + SO2↑+ 2H2O;氧化;Cu失去电子生成了Cu2+;(2)a
(3)第一份:SO2 + 2OH- == SO32- + H2O ,Ba2+ + SO32- == BaSO3↓(或SO2 + 2OH- + Ba2+ == H2O + BaSO3↓) 第二份:SO2 + Cl2 + H2O == 4H+ + 2Cl- + SO42- ,Ba2+ + SO42- == BaSO4↓(SO2 + Cl2 + 2H2O + Ba2+ =
4H+ + 2Cl- + BaSO4↓);(4)吸收SO2尾气;(5)开始没有明显现象,后有蓝色沉淀生成。
【解析】
试题分析:(1)①中的反应是制备SO2,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O;根据反应方程式,Cu
CuSO4+SO2↑+H2O;根据反应方程式,Cu
由0价→+2价,化合价升高,失电子,Cu是还原剂被氧化,因此铜发生了氧化,判断的依据:Cu失去电
子生成了Cu2+;(2)①中铜丝是可以移动的,上移铜丝,铜丝不跟硫酸接触反应立即停止,a正确;b、撤去
酒精灯,试管温度还高,反应不会立即停止;c、拔去橡胶塞倒出硫酸,造成SO2跑出,发生危险,不可行
(3)SO2易溶于水,BaCl2溶液中溶解了一部分SO2,第一份中:加入NaOH溶液,发生:SO2 + 2OH- =SO32- +
H2O ,Ba2+ + SO32- =BaSO3↓;第二份中:SO2既具有氧化性也具有还原性,但以还原为主,Cl2具有强氧化
性,发生:SO2 + Cl2 + H2O =4H+ + 2Cl- + SO42- ,Ba2+ + SO42- =BaSO4↓;(4)④因为SO2有毒,如果跑出对
环境产生污染,必须除去,因此棉花的作用是除去SO2尾气;(5)铜只跟浓硫酸反应,不与稀硫酸反应,因
此硫酸剩余,当加入NaOH溶液时,先发生中和反应H++OH-=H2O,根据题意分析白色固体是CuSO4,
如果继续滴加NaOH溶液,发生:Cu2++2OH-=Cu(OH)2↓,因此现象是开始无明显现象,后有蓝色沉淀生
成。

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑