磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式.
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子.
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 4 molB﹣P键.
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 .

答案
考点:
晶胞的计算;原子核外电子排布;晶体的类型与物质熔点、硬度、导电性等的关系;原子轨道杂化方式及杂化类型判断.
专题:
原子组成与结构专题;化学键与晶体结构.
分析:
(1)其基态原子具有八种不同能量电子,该原子的能级有1S、2S、2P、3S、3P、3d、4S、4P,据此确定该元素;
(2)没有孤电子对的原子提供空轨道;
(3)根据其空间结构确定晶体类型,根据每个B原子含有的价层电子对个数确定杂化方式,根据每个B原子含有的B﹣P键个数计算;
(4)得电子能力越强的元素其电负性越强;
(5)根据电子对互斥理论确定其空间构型,根据空间构型确定键角;
(6)原子晶体中,物质熔点与原子半径、键长成反比.
解答:
解:(1)其基态原子具有八种不同能量电子,该原子的能级有1S、2S、2P、3S、3P、3d、4S、4P,所以该元素是第四周期的P区元素,为Br元素,其基态原子的价电子轨道表示式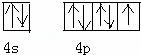 ,故答案为:
,故答案为: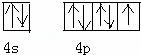 ;
;
(2)没有孤电子对的原子提供空轨道,B原子没有孤电子对,所以提供空轨道,P原子提供孤电子对,故答案为:B;
(3)根据其根据结构知,该物质为空间网状结构,所以是原子晶体,每个B原子含有4个σ键不含孤电子对,所以采取sp3杂化,每个B原子含有4个B﹣P键,所以每生成1molBP,共形成4molB﹣P键,故答案为:原子晶体,sp3;4;
(4)BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,则P元素得电子能力比B元素强,得电子能力越强的元素其电负性越强,所以电负性P>B,故答案为:>;
(5)BBr3分子中,B原子含有3个σ键不含孤电子对,所以采取sp2杂化,为平面三角形结构,键角是120℃,故答案为:sp2;120°;
(6)原子晶体中,物质熔点与原子半径、键长成反比,磷原子的半径比氮原子大,N﹣B共价键键长比B﹣P小,键能大,所以氮化硼晶体的熔点要比磷化硼晶体高,
故答案为:磷原子的半径比氮原子大,N﹣B共价键键长比B﹣P小,键能大.
点评:
本题考查了物质结构的综合性知识,原子的杂化方式、分子的空间构型、键角等知识点是高考的热点,应重点掌握.
