请在标有序号的空白处填空。
(1)可正确表示原子轨道的是____①____。
A.2s B.2d C.3px D.3f
(2)写出基态镓(Ga)原子的电子排布式:____②____。
(3)下列物质变化,只与范德华力有关的是__③____。
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D.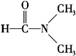 溶于水
溶于水
E.碘溶于四氯化碳
F.石英熔融
(4)下列物质中,只含有极性键的分子是____④____,既含离子键又含共价键的化合物是____⑤____;只存在σ键的分子是____⑥____,同时存在σ键和π键的分子是____⑦____。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6
F.CaCl2 G.NH4Cl
(5)用“>”“ <”或“=”填空:
第一电离能的大小:Mg____⑧____Al;
熔点的高低:KCl____⑨____MgO。
答案
【解析】(1)主量子数为2的能级包括s、p;主量子数为3的能级包括s、p、d;
(2)镓(Ga)的原子序数为31,电子分布的能级为1s、2s、2p、3s、3p、3d、4s、4p。
(3)范德华力存在于分子之间,不含氢键的分子晶体符合题目要求。乙酸、乙醇![]() 、
、![]() 分子间存在氢键,石英为原子晶体,熔融时破坏的是共价键。
分子间存在氢键,石英为原子晶体,熔融时破坏的是共价键。
(4)不同![]() 元素的原子之间形成的共价键为极性键,同种原子之间形成的共价键是非极性键;活
元素的原子之间形成的共价键为极性键,同种原子之间形成的共价键是非极性键;活![]() 泼金属元素和活泼非金属元素形成离子键,铵盐中存在离子键;只形成单键的共价键只存在σ键,含有双键或三键的物质同时存在σ键和π键。故只含有极性键的是CH2Cl2、CO2;既含有离子键又含有共价键
泼金属元素和活泼非金属元素形成离子键,铵盐中存在离子键;只形成单键的共价键只存在σ键,含有双键或三键的物质同时存在σ键和π键。故只含有极性键的是CH2Cl2、CO2;既含有离子键又含有共价键![]() 的化合物是NH4Cl;只存在σ键的分子是CH2Cl2、C2H6;同时存在σ键和π键的分子是N2、CO2、C2H4。
的化合物是NH4Cl;只存在σ键的分子是CH2Cl2、C2H6;同时存在σ键和π键的分子是N2、CO2、C2H4。
(5)同周期从左到右第一电离能增大,但第2、3、4周期中第ⅡA族的第一电离能比相邻的第ⅠA和第ⅢA族的大;KCl与MgO均为离子晶体,晶格能的大小决定熔点高低,KCl与MgO晶胞类型相同,半径r(K+)>r(Mg2+),电荷Mg2+>K+,故MgO的晶格能大于KCl,故熔点KCl<MgO。
答案:①A、C ②1s22s22p63s23p63d104s24p1
③![]() A、E ④B、C ⑤G ⑥C、E ⑦A、B、D
A、E ④B、C ⑤G ⑥C、E ⑦A、B、D
⑧> ⑨<
