钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
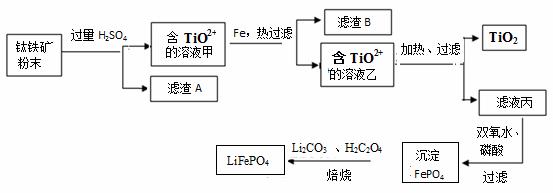
已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。

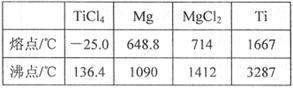 (6)TiO2制取单质Ti,涉及到的步骤如下:
(6)TiO2制取单质Ti,涉及到的步骤如下:
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是 , 由TiCl4→Ti需要在Ar气中进行的理由是 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
答案
【答案】I.(1)+2 (1分) (2)SiO2 (1分)
(3)TiO2-+H2O![]() TiO2↓+2H+ (2分)
TiO2↓+2H+ (2分)
(4)20:9 (2分)
(5)cVM/1000W 或 cVM/1000W ×100﹪(2分)
(6)TiCl4 +2Mg ![]() 2MgCl2 + Ti (2分);防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分) 1412 (2分)
2MgCl2 + Ti (2分);防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分) 1412 (2分)
【命题立意】本题考查学生利用钛铁矿制备二氧化钛的工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等;
【解析】(1)钛铁矿的主要成分为FeTiO3 ,可表示为FeO·TiO2 ,可知Fe的化合价为+2价;(2)钛铁矿中只有SiO2不与硫酸反应,因此滤渣A的成分是SiO2。(3)TiO2+转化为TiO2,Ti的化合价不变,发生的是TiO2+的水解反应,过滤后未加其他反应物,所以TiO2+与H2O反应,生成TiO2,同时生成H+,反应方程式为:TiO2-+H2O![]() TiO2↓+2H+;(4)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9;(5) 根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数为为:cVM/1000W 或 cVM/1000W ×100﹪;(6)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,反应方程式为:TiCl4 +2Mg
TiO2↓+2H+;(4)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9;(5) 根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数为为:cVM/1000W 或 cVM/1000W ×100﹪;(6)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,反应方程式为:TiCl4 +2Mg ![]() 2MgCl2 + Ti;Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气, 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用;由表中数据可知,Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当加热的温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti。
2MgCl2 + Ti;Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气, 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用;由表中数据可知,Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当加热的温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti。

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L