下列各图与表述一致的是( )
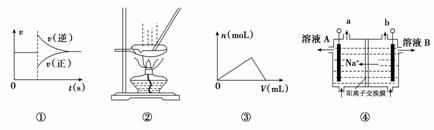
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.用图②所示装置蒸发AlCl3溶液制备无水AlCl3
C.图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D.图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B
答案
【答案】C;
【命题立意】本题考查化学反应原理及反应图像;
【解析】升高温度,正、逆反应速度均加快,降低温度,正、逆反应速率均变慢,A错误;蒸发AlCl3溶液会促进Al3+的水解,得不到AlCl3,B错误;向含Al3+的明矾溶液中滴入Ba(OH)2,形成沉淀消耗的Ba(OH)2和溶解沉淀消耗的Ba(OH)2的体积之比为3∶1,C正确;电解池工作过程中,阳离子移向阴极,故左边为阴极、右边为阳极,阴极区产物为H2和NaOH,溶液呈碱性会抑制水的电离,溶液A、B中由水电离出的c(H+):A<B,D错误;

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L