某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
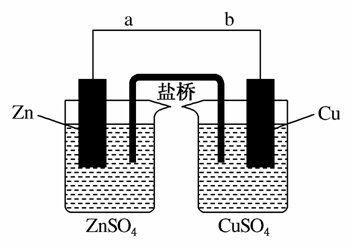
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________(用a、b表示);
(2)写出装置中镀锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为__________;(不许用“NA”表示);
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向向表述正确的是__________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
A.NaOH B.Zn
C.Fe D.H2SO4
答案
答案 (1)由a到b(或a→b)
(2)Zn-2e-===Zn2+
(3)1.204×1022
(4)B (5)B
解析 在该原电池中负极为Zn,电极反应为Zn-2e-===Zn2+,正极为铜,电极反应为Cu2++2e-===Cu,当铜电极增加0.64 g时,转移电子(由a到b)为![]() ×6.02×1023mol-1×2=1.204×1022,盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。除去ZnSO4中的杂质Cu2+,且不引入新的杂质,所以可选择Zn,发生反应为Zn+Cu2+===Zn2++Cu,过量的Zn及生成的Cu过滤可除去。
×6.02×1023mol-1×2=1.204×1022,盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。除去ZnSO4中的杂质Cu2+,且不引入新的杂质,所以可选择Zn,发生反应为Zn+Cu2+===Zn2++Cu,过量的Zn及生成的Cu过滤可除去。
