I. 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
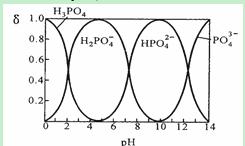
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
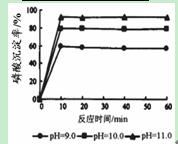
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:
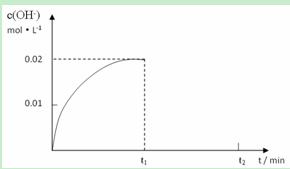
①求该温度时,氨水的电离平衡常数K为多少?
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1 ~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
答案
I. ①酸 (1分); H2PO4-在溶液中的电离程度大于水解程度。(1分)
② > (1分), KOH抑制了PO43-的水解(1分);③0.056mmol·/(L·min)(2分)
II. ①4.00×10-4 (2分)

②如图(2分) ③ ![]() mol/L (2分)
mol/L (2分)

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L