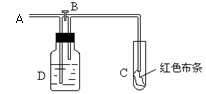
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl
2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl
2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl
2
2FeCl
3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl
2
CuCl
2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
②与非金属的反应 H
2+Cl
2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H
2+Cl
2
2HCl(发生爆炸) 2P+3Cl
2
2PCl
3(液态) PCl
3+Cl
2==PCl
5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl
3,烟是PCl
5。氯气能有很多非金属单质反应,如S、C、Si等。
③与碱反应 Cl
2+2NaOH==NaCl+NaClO+H
2O 2Cl
2+2Ca(OH)
2==CaCl
2+Ca(ClO)
2+2H
2O
④与某些还原性物质反应:Cl
2+2FeCl
2===2FeCl
3 Cl
2+SO
2+2H
2O==2HCl+H
2SO
4 ⑤有机反应(参与有机反应的取代和加成反应)
CH
4+Cl
2→CH
3Cl+HCl
CH
3Cl+Cl
2→CH
2Cl
2+HCl
CH
2Cl
2+Cl
2→CHCl
3+HCl
CHCl
3+Cl
2→CCl
4+HCl
Cl
2+CH
2=CH
2→CH
2Cl-CH
2Cl(加成反应)
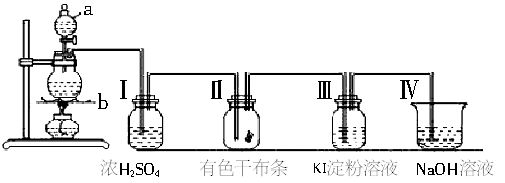
⑥与水反应 Cl
2+H
2O

HCl+HClO




 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO