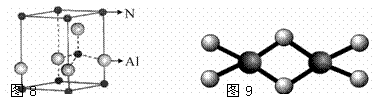
用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图8所示)可由氯化铝与氨经气相反应制得。
 |
(1)基态Cr的价电子排布式可表示为 ▲ 。
(2)氮化铝的化学式为 ▲ ,距离铝原子最近且距离相等的氮原子数目为 ▲ 个。
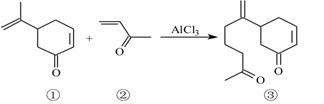
(3)氯化铝易升华,其双聚物Al2Cl6结构如图9所示。在Al2Cl6中存在的化学键有 ▲ (填字母)。
a.离子键 b.共价键 c.配位键 d.金属键
(4)一定条件下用Al2O3和CCl4反应制备AlCl3的反应为:Al2O3+3CCl4===2AlCl3+3COCl2。其中COCl2分子的空间构型为 ▲ 。一种与CCl4互为等电子体的分子的化学式为 ▲ 。
(5)AlCl3在下述反应中作催化剂。分子③中碳原子的杂化类型为 ▲ 。
 |
答案
【知识点】原子核外电子排布;化学键;判断简单分子或离子的构型.
【答案解析】(1)3d54s1 (2)AlN 4 (3)bc (4)平面三角形 SiCl4 (5)sp2和sp3
解析::(1)铬24号元素,根据构造原理知,基态Cr的价电子排布式可表示为3d54s1
(2)氮化铝晶胞中N原子的个数=8×1/8+1=2,Al原子的个数=4×1/4+1=2,所以氮化铝的化学式为AlN;距离铝原子最近且距离相等的氮原子数目为4;
(3)双聚物Al2Cl6形式存在,氯化铝中铝原子最外层电子只有3个电子,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供,所以含有配位键,则在Al2Cl6中存在的化学键有共价键、配位键,故选bc;
(4)COCl2分子的结构式为![]() ,C=O中含有1个δ键、1个π键,碳原子的杂化方式为SP2杂化,
,C=O中含有1个δ键、1个π键,碳原子的杂化方式为SP2杂化,
分子的空间构型为平面三角形;与CCl4互为等电子体的分子的化学式为: SiCl4
分子③中的碳原子有些是形成4个σ键,无孤电子对,有些是形成3个σ键,无孤电子对,所以碳原子的杂化方式为sp2和sp3;
【思路点拨】本题考查物质结构,涉及化学式的确定、杂化方式的确定、核外电子排布式的书写等知识,利用均摊法、价层电子对互斥理论、构造原理来分析解答即可,难度不大.
