洗车安全气囊是德国安![]() 全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
答案
【解析】
本题知识载体很新鲜,很生活,很化学。简答式的题目首先要进行分析,确定设计的物质及反应才能完成各小题的内容。
题目关键词:粉末分解释放氮气,粉末仅含Na、Fe、N、O,水溶性试验部分溶解,可溶部分为化合物甲,不溶物红棕色可溶于盐酸。13.0g甲完全分解为N2和单质乙,N26.72L,单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
解题分析:1、粉末由两种物质混合而成。2、红棕色物质可能为Fe2O3\Fe(OH)3等,根据题意只能是Fe2O3。3、甲只有两种元素,且含N,必含Na。3、计算:N(6.72/22.4)*2*14=8.4g,则Na的物质的量为:(13-8.4)/23=0.2mol,N与Na的物质的量之比为:0.6:0.2=3:1,则化合物甲为Na3N。4、在高温下Na与Fe2O3反应的产物为Na2O2和Fe。
【答案】(1)Na3N,![]() (2)2N2O2+4CO2+2H2O=4NaHCO3+O2
(2)2N2O2+4CO2+2H2O=4NaHCO3+O2
 (3)6Na+2Fe2O3=3Na2O2+4Fe ,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。实验设计一:实验原理:定量分析法。步骤:1、称量混合固体的质量。2、将混合物加热,并将气体通入澄清石灰水,无气体则无NaHCO3,石灰水变浑浊则有NaHCO3无NaOH,称量石灰水质量变化量mg。3、加入过量盐酸,将产生的气体通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生
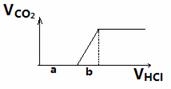
(3)6Na+2Fe2O3=3Na2O2+4Fe ,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。实验设计一:实验原理:定量分析法。步骤:1、称量混合固体的质量。2、将混合物加热,并将气体通入澄清石灰水,无气体则无NaHCO3,石灰水变浑浊则有NaHCO3无NaOH,称量石灰水质量变化量mg。3、加入过量盐酸,将产生的气体通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生![]() 二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
教与学提示: 题型的难点1是通过定性和定量两种方式确定物质的化学
成分,其中Na3N又是学生很不熟悉的。难点2是氧化还原方程式的书写与配平,及氧化还原原理的应用。难点3是实验设计,通过定量来定性。但,题目设计与问题设计都在平时的练习与讨论中必然会涉及。比如实验设计部分,在省市多次统考中均有有关碳酸盐与酸反应定量问题出现过,或反复练习过。但,在简答的环境中也还是有难度的。解题中要动用到平时知识的积累,决定成败还是在平时。

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑