已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10—5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L的HSCN溶液
分别与0.10 mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积V
与时间t的关系如图甲所示:
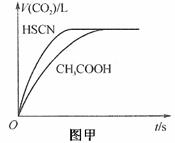
反应开始时,两种溶液产生CO2的速率明显不同的原因是____________
_________________________________________________;反应结束后所得溶液中c(SCN—)______c(CH3COO—) (填“>”、“=”或“<”)。
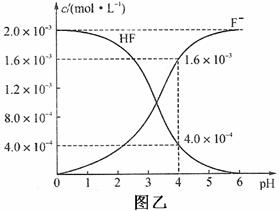
(2)2.0×10—3 mol/L的HF水溶液中,调节溶液pH(忽略调节pH时溶液的
体积变化),测得平衡体系中c(F—)、c(HF)与溶液pH的关系如图乙所示。
则25℃时,HF电离平衡常数为Ka(HF)=_____________________________
______________________(列式并求值,不写单位)。
(3)难溶物CaF2溶度积常数(Ksp)= 1.5×10—10,将4.0×10—4mol/L的HF溶液
与4.0×10—4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节
pH时溶液的体积变化),试分析混合后是否有沉淀生成?________(填“有”
或“没有”),简述理由:__________________________________________。
答案
(1)因为Ka(HSCN)>Ka(CH3COOH),溶液中HSCN电离出的c(H+)比CH3COOH电离的大,故HSCN溶液中产生CO2的速率快。(2分);
>(1分)
(2)Ka(HF)=![]() (2分)
(2分)
(3)有(1分),
因溶液中c(Ca2+)• c2 (F—)=5.12×10—10 >Ksp(CaF2)=1.5×10—10(2分)

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L