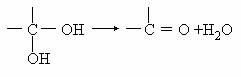某有机物的相对分子质量为102。
(1)经测定,该有机物含碳氢氧三种元素,其中含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。该有机物的分子式是 ▲ ;若该有机物无甲基无醚键,且能发生银镜反应,则该有机物的官能团的名称 ▲ ▲ ,写出该有机物与新制的氢氧化铜的反应的化学方程式 ▲ 。
(2)经红外光谱测定,该有机物分子中含有一个羧基、一个羟基和一个碳碳双键,则其可能的结构简式为 ▲ (提示:羟基不能连在碳碳双键上)。
(3)经测定,该有机物只含碳氢两种元素,且所有原子均在同一平面,请写出该有机物的结构简式 ▲ 。
答案
(1)C5H10O2(2分);羟基、醛基(2分)![]() (2分)
(2分)
(2)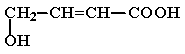 、
、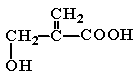 、
、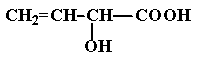 (4分)(写对Ks5u一个给1分,三个全写对给4分)
(4分)(写对Ks5u一个给1分,三个全写对给4分)
(3)![]() (2分)
(2分)