乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O

图6-3
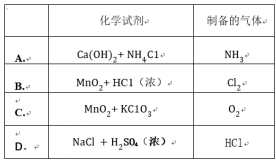
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。
答案
(1)乙 冷凝效果好,乙醚远离火源,防止乙醚因挥发而引起燃烧
(2)防暴沸
(3)反应混合物液面以下,但不能接触瓶底
(4)乙醇 将反应后所得混合液与饱和Na2CO3溶液混合、静置、分液
(5)消去 乙烯
解析:
本题主要考查了获取信息的能力与对已学知识的迁移能力。通过乙醚的沸点(34.6 ℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险。由于乙醇的沸点(78 ℃)与反应温度(140 ℃)相差不是太大,随着反应温度的提高会有较多的乙醇挥发出来,故应考虑用Na2CO3溶液将乙醚与乙醇分离。