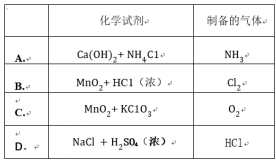
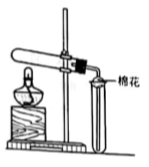
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如下实验装置(夹持仪器已略去)。

(1)实验前如何检查装置A的气密性?______________________________。
(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强。
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a.乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀。
b.该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应。
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行的是__________(填序号)。
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是__________(填序号)。
①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸。
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:________________________________________。
答案
Ⅰ.(1)仪器连接好后,将止水夹夹紧,在A中加入水使U形管左右两边管中产生液面差,一段时间后,U形管中左右两边管中的液面未发生变化(其他合理答案也可)
(2)① ③
Ⅱ.取pH=3的乙酸溶液加入蒸馏水稀释100倍,用pH试纸测定溶液的pH小于5
解析:Ⅰ.(2)在A、B之间接盛有足量饱和NaHCO3溶液的洗气瓶,可以吸收CO2中的乙酸,且不吸收CO2.
相同浓度的Na2CO3溶液pH比Na2SiO3 pH小,说明![]()
Ⅱ.利用在乙酸溶液中存在平衡CH3COOH![]()