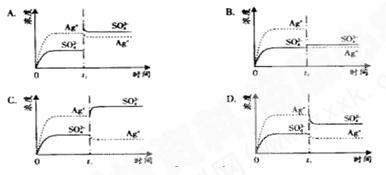
已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO![]() 浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO![]() 浓度随时间变化关系的是( )
浓度随时间变化关系的是( )
【错误分析】多数同学对溶解平衡计算较为生疏,没有解![]() 题思路,乱选。
题思路,乱选。
【答案】B
【状元纠错】离子的溶度积与Ksp间的关系不明确。Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q<Ksp)。由计算可知选B。
下列物质在温度和物质的量浓度相同时,在水溶液中含有的微粒种类最多的是
A.NaH2PO4 B.K3[Fe(SCN)6] C.(NH4)2S D.光卤石
【答案】B
【解析】 NaH2PO4溶液中存在以下电离和平衡:
![]()
![]()
![]()
![]()
![]()
![]()
7种微粒。(NH4)2S溶液中有类似情况,也存在7![]() 种微粒(不妨自己练习写出)。
种微粒(不妨自己练习写出)。
本题的正确答案应是选项B,因为3价铁离子能和1~6个硫氰根离子络合平衡,即:[来
![]()
……
![]()
![]()
SCN-,H+和OH-等11种微粒。
【状元纠错】 由于知识的欠缺,产生不同的错误结果。既然都是盐溶液,而大多数的盐都属于强电解质,在水中全部电离。因此,得出复盐和络盐电离出的离子种类最多——低级错误,选择了BD选项。但错误较多的是对盐溶液中存在哪些平衡不了解,盐电离生成的离子可能存在电离(多元弱酸的酸式根或络离子)或水解(弱酸根或弱碱对应的金属离子)平衡,这些平衡中将产生多种微粒。
Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
A.[Na+]>[S2-]>[OH-]>[HS-]>[H+]
B.[Na+]+[H+]==[S2-]+[HS-]+[OH-]
C.[Na+]==[HS-]+2[H2S]+2[S2-]
D.[OH-]==[H+![]() ]+[HS-]+[H2S]
]+[HS-]+[H2S]
【答案】 A
【解析】 选项A,可以半定量地分析得出结论。假设Na2S的浓度为0.1mol·L-1,则[Na+]为0.2mol·L-1;硫离子少部分发生水解,其平衡浓度比0.1mol·L-1小,而水解生成硫氢根离子和氢氧根离子的浓度远远小于0.1mol·L-1(仍大于0.001mol·L-1);由于硫氢根离子受到一定浓度的氢氧根离子影响(抑制其水解),其还要发生微弱的水解(存在电离和水解两种趋势,但水解趋势大于电离趋势),这样氢氧根离子的浓度将大于硫氢根离子的浓度;溶液呈碱性,其[H+]将由水的离子积和[OH-]求出,很明显其浓度远远小于[HS-](其与[OH-]在同一数量级上)。
【状元纠错】电解质的水溶液中一定存在两个守恒:①物质守恒,②电荷守恒。通俗的说:①各种元素的微粒既不可增加也不可减少;②电解质溶液中存在各种带电的微粒,但所带电量的代数和等于零,即溶液不带电。结合本题有如下两个等式:(在同一体积中,用浓度表示即可)
物质守恒:
[Na+]==2[HS-]+2[H2S]+2[S2-] ①
电荷守恒:[Na+]+[H+]==2[S2-]+[HS-]+[OH-] ②
在物质守恒中,应该找出该元素可能转化生成的各种微粒。如本题的硫元素,它来源于Na2S中的S2-,少量的S2-要水解转化成HS-,微量的HS-进一步水解转化成H2S,虽然生成H2S的量很小,很小,但在理论上不能没有。另外,含硫元素的各种微粒与钠离子的物质的量之比应符合原化学式中各微粒的比值。选项C违背了上述要求。
在电荷守恒中,如何计算带多个单位电荷的微粒所带电量,往往容易出现误解。从表面形式上看,该微粒已带多个单位电荷,若用其所带电荷数乘以其浓度,似乎远远大于实际所带电量。实际上浓度只表示该微粒在单位体积里其物质的量(微粒)的多少,并不表示它带电量的多少。用其所带电荷数乘以其浓度,恰好计算其所带电量。选项B即错在此处。
由上述两个等式,通过代入变换,还可得到多个![]() 其他形式的等式。如②-①的整理得:[OH-]==[H+]+[HS-]+2[H2S],可判断选项D是错误答案。
其他形式的等式。如②-①的整理得:[OH-]==[H+]+[HS-]+2[H2S],可判断选项D是错误答案。
下列离子反应方程式书写正确的是
A.过量磷酸加入磷酸钠溶液中
![]()
B.2.24L(标况下)氯气和100mL1mol·L-1溴化亚铁溶液反应
3Cl2+2Fe2++4Br-==6Cl-+2Fe3++2Br2
C.碳酸氢镁的溶液中加入石灰水
![]()
D.用氯化铁溶液检验苯酚存在
Fe3++6C6H5OH==[Fe(C6H5O)6]3-+6H+
【答案】 D
 【状元纠错】 由于知识的缺陷:①往往对不该写离子的写成离子。如备选答案中的A,磷酸虽是中强酸,但仍属于弱酸、弱电解质,应保留分子形式。其离子方程式为:
【状元纠错】 由于知识的缺陷:①往往对不该写离子的写成离子。如备选答案中的A,磷酸虽是中强酸,但仍属于弱酸、弱电解质,应保留分子形式。其离子方程式为:
![]()
②对反应的产物判断有误。如备选答案中的C,碳酸氢镁和氢氧化钙反应时,由于碳酸镁为微溶物,而氢氧化镁是难溶物,所以产物应为氢氧化镁。其离子方程式为:
![]()
![]() 对备选答案中B的判断还应考虑反应物
对备选答案中B的判断还应考虑反应物![]() 数量的关系。根据题目给的信息,0.1mol的氯气和0.1mol的溴化亚铁反应,根据微粒氧化能力由强到弱的顺序为:Cl2>Br2>Fe2+,0.1mol的氯气能氧化0.1mol的Fe2+和0.1mol的Br-,所以该反应方程式中Fe2+和Br-系数应相等,该反应的离子方程
数量的关系。根据题目给的信息,0.1mol的氯气和0.1mol的溴化亚铁反应,根据微粒氧化能力由强到弱的顺序为:Cl2>Br2>Fe2+,0.1mol的氯气能氧化0.1mol的Fe2+和0.1mol的Br-,所以该反应方程式中Fe2+和Br-系数应相等,该反应的离子方程![]() 式为:
式为:
2Cl2+2Fe2++2![]() Br-==4Cl-+2Fe3++Br2
Br-==4Cl-+2Fe3++Br2
将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
A.NaOH溶液 B.蒸馏水 C.Na2SO3溶液 D.KI溶液
【答案】C
【解析】 由于氯气和亚硫酸钠发生如下反应:
Cl2+Na2SO3+H2O==2HCl+Na2SO4
从吸收容量上看:用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电量总量看),符合导电的灵敏度增大,导电性增强。选项C为正确答案。
【状元纠错】本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如:1mol任何气体在标况下的体积为22.4L;1mol水18mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的物质的量要大,吸收的容量将更大。
错解之二是知识欠缺,只知道氯气能和NaOH溶液反应,生成氯化钠和次氯酸钠,生成物的种类增多,导电的离子浓度增大。因此,兼顾容量和导电性变化的灵敏度。实际上氯气和氢氧化钠的反应如下:
Cl2+2NaOH==NaCl+NaClO+H2O
2molNaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电的灵敏度不变。
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。