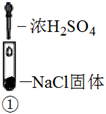
下列实验操作与现象不相匹配的是
| 实验操作 | 实验现象 | |
| A | 向盛有Ba(NO3)2溶液的试管中通入CO2 | 产生白色沉淀 |
| B | 向盛有KI溶液的试管中滴加氯水和CCl4液体,振荡 | 下层溶液变为紫红色 |
| C | 向盛有Na2S2O3溶液的试管中先滴入酚酞溶液,然后滴加盐酸,边滴边振荡。 | 溶液先变红后褪色,有气泡产生并出现浑浊 |
| D | 向盛有FeCl3溶液的试管中先加入足量锌粉,充分振荡后加2滴 | 溶液黄色逐渐消失,加 |
A.A B.B C.C D.D
A
【详解】
A.向盛有Ba(NO3)2溶液的试管中通入CO2,相当于讨论H2CO3与Ba(NO3)2复分解反应能不能发生?用弱酸不能制强酸,不反应无现象,A项实验操作与现象不相匹配, A项错误;
B.向盛有KI溶液的试管中滴加氯水和CCl4液体, Br2+2KI =I2+2KBr,I2易溶于CCl4 显紫红色,B项操作与现象相匹配,B项正确;
C.由于硫代硫酸根离子水解溶液呈碱性,滴入酚酞溶液先变红,然后滴加盐酸溶液,发生反应 Na2S2O3+2HCl=SO2↑+S↓+2NaCl+H2O,反应后溶液呈中性,红色褪去,C项操作与现象相匹配,C项正确;
D.向盛有FeCl3溶液的试管中先加入足量锌粉,发生反应:Zn+2FeCl3═2FeCl2+ZnCl2,三价铁变二价铁溶液,溶液黄色逐渐消失,加![]() 溶液产生深蓝色沉淀,D项操作与现象相匹配,D项正确;
溶液产生深蓝色沉淀,D项操作与现象相匹配,D项正确;
答案选A。
ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
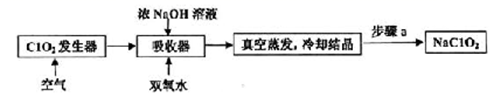
A.通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C.步骤a的操作包括过滤、洗涤和干燥
D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
B
【详解】
A.在ClO2发生器中一定产生ClO2气体,通入空气,可以将其吹入吸收塔中进行吸收,选项A正确;
B.吸收塔中加入了浓氢氧化钠溶液,显然其中的反应不可能得到氢离子,选项B错误;
C.冷却结晶得到NaClO2固体后,应该经过过滤,洗涤,干燥得到产品,选项C正确;
D.气体的贮存和运输都远比固体困难,所以将ClO2气体制成NaClO2固体的主要目的是便于贮存和运输,选项D正确。
答案选B。
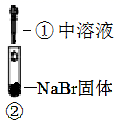
某小组比较Cl-、Br-、I- 的还原性,实验如下:
| 实验1 | 实验2 | 实验3 | |
| 装置 |
|
|
|
| 现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A.实验1中,白烟是NH4Cl B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br- D.上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
C
【分析】
实验1,浓硫酸与氯化钠固体反应生成氯化氢气体;实验2,溶液变黄,说明有溴单质生成;②中溶液含有浓硫酸和溴单质,加入碘化钠生成碘单质,可能是浓硫酸把碘离子氧化为碘单质;实验1体现浓硫酸的难挥发性、实验2体现浓硫酸的氧化性;
【详解】
实验1,试管口挥发出的氯化氢气体与浓氨水挥发出的氨气反应生成白烟氯化铵,故A合理;实验1溶液颜色无明显变化说明浓硫酸不能氧化氯离子,实验2溶液变黄说明浓硫酸能氧化溴离子,所以判断还原性:Br->Cl-,故B合理;②中溶液含有浓硫酸和溴单质,加入碘化钠生成碘单质,可能是浓硫酸把碘离子氧化为碘单质,不能得出还原性I->Br-的结论,故C不合理;实验1体现浓硫酸的难挥发性、实验2体现浓硫酸的氧化性,故D合理;选C。
化学与生活密切相关,下列说法错误的是:
A.纤维素和淀粉水解的最终产物相同
B.二氧化硫有漂白性,可用于纸浆的漂白
C.车用乙醇汽油的使用有利于减少人类对石油的依赖
D.加碘食盐中含碘物质主要是KI
D
【详解】
A项,纤维素和淀粉水解的最终产物都是葡萄糖,A项正确;
B项,SO2具有漂白性,可用于漂白纸浆、毛、丝、草帽辫等,B项正确;
C项,传统汽油主要来源于石油,石油属于非再生能源,乙醇主要通过糖类农作物和纤维类植物原料来生产,糖类农作物和纤维类植物相比石油都是可再生能源,车用乙醇汽油的使用有利于减少人类对石油的依赖,C项正确;
D项,加碘食盐中的含碘物质主要是KIO3,D项错误;
答案选D。
化学与生产、生活、社会密切相关,下列说法错误的是
A.中国古代利用明矾溶液清除铜镜表面的铜锈,是利用了明矾溶液的酸性
B.碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群
C.“光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B
【详解】
A,明矾溶于水电离出Al3+,Al3+发生水解使明矾溶液呈酸性,铜锈的主要成分Cu2(OH)2CO3与H+反应而溶解,利用明矾溶液的酸性清除铜镜表面的铜锈,A项正确;B,碘是人体内必须的微量元素,加碘盐中加入碘酸钾,高碘同样对人体有害,对于不缺碘的人群无需补碘, B项错误;C,氮氧化合物可以引起光化学烟雾、形成硝酸型酸雨(3NO2+H2O=2HNO3+NO)、破坏臭氧层,C项正确;D,高纯度的SiO2用于制作光导纤维,SiO2与强碱发生反应:SiO2+2OH-=SiO32-+H2O,光导纤维遇强碱会“断路”,D项正确;答案选B。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。