国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
D
【详解】
A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;
B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B说法正确;
C.过氧乙酸的分子式为C2H4O3,故其相对分子质量为76,C说法正确;
D.氯仿的化学名称为三氯甲烷,D说法不正确。
综上所述,故选D。
下列有关化学用语表示正确的是( )
A.N2H4的结构式:![]() B.Fe的原子结构示意图:
B.Fe的原子结构示意图:![]()
C.SO2分子的空间结构模型:![]() D.基态N原子的轨道表示式:
D.基态N原子的轨道表示式:![]()
B
【详解】
A.氮原子成3键,氢原子成1键,所以 N2H4的结构式: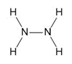 ,A错误;
,A错误;
B. Fe是26号元素,其原子结构示意图:![]() ,B正确;
,B正确;
C. SO2分子的空间结构为V形,其模型: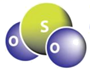 ,C错误;
,C错误;
D. 电子优先单独占据1个轨道,且自旋方向相同,N原子核外有7个电子,分2层排布,基态N原子的轨道表示式:![]() ,D错误;
,D错误;
故答案为:B。
下列有关物质性质与用途对应关系不正确的是
A.NaHCO3能与碱反应,可用作焙制糕点的膨松剂
B.CaO能与SO2反应,可作为工业废气处理时的脱硫剂
C.硅的导电性介于导体和绝缘体之间,可用于制造计算机硅芯片的材料
D.饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强
A
【详解】
A.NaHCO3不稳定,受热分解产生CO2气体,能够使面团松软,因而可用作焙制糕点的膨松剂,A错误;
B.碱性氧化物CaO能与SO2反应产生固态的盐,因而可作为工业废气处理时的脱硫剂,减少对大气的污染,B正确;
C.硅的导电性介于导体和绝缘体之间,是良好的半导体材料,因而是制造计算机硅芯片的材料,C正确;
D.Cl2溶于水,与水反应产生HCl、HClO,溶液中含有HCl使溶液显酸性,而HClO具有强氧化性,能够将有色物质氧化变为无色,因此饱和氯水既有酸性又有漂白性。氯气与水的反应是可逆反应,由于酸性:HCl>H2CO3>HClO,加入适量NaHCO3固体,反应消耗HCl,使化学平衡正向移动,导致溶液中c(HClO)增大,因而其漂白性增强,D正确;
故合理选项是A。
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层的3倍,金属元素Y原子核外无未成对电子, Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.W的最高价氧化物对应的水化物是强酸
B.X的简单气态氢化物的沸点比W的高
C.Y的第一电离能比同周期相邻元素的大
D.1mol单质Z中共价键的数目约为4×6.02×1023
D
【分析】
短周期主族元素X、Y、Z、W的原子序数依次增大,由X原子的最外层电子数是次外层的3倍可知,X为O元素;由金属元素Y原子核外无未成对电子可知,Y为Mg元素;由Z的单质晶体是应用最广泛的半导体材料可知,Z为Si元素;由W与X位于同一主族可知,W为S元素。
【详解】
A.硫元素的最高价氧化物对应的水化物是硫酸,硫酸是二元强酸,故A正确;
B.水分子间能形成氢键,硫化氢分子间不能形成氢键,则水的的沸点比硫化氢高,故B正确;
C.同周期元素,从左到右,第一电离能有增大的趋势,镁的价电子排布式为3s2,3s轨道为全充满的稳定状态,第一电离能比同周期相邻元素的大,故C正确;
D.硅单质为原子晶体,一个硅原子周围有四个硅原子,每个硅原子形成共价键的数目为4×![]() =2,则1mol单质硅中共价键的数目约为2×6.02×1023,故D错误;
=2,则1mol单质硅中共价键的数目约为2×6.02×1023,故D错误;
故选D。
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1NaOH溶液:Na+、K+、S2-、![]()
B.0.1 mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、SCN-、
、SCN-、![]()
C.0.1 mol·L-1KI溶液:Na+、K+、ClO-、OH-
D.0.1 mol·L-1NH4HCO3溶液:Ba2+、K+、OH-、![]()
A
【详解】
A.0.1 mol·L-1NaOH溶液显碱性,在碱性溶液中,选项离子之间不能发生任何反应,可以大量共存,A符合题意;
B.在0.1 mol·L-1Fe2(SO4)3溶液中,Fe3+与SCN-会发生络合反应产生Fe(SCN)3,不能大量共存,B不符合题意;
C.在0.1 mol·L-1KI溶液中含有大量I-,I-与ClO-会发生氧化还原反应,不能大量共存,C不符合题意;
D.NH4HCO3电离产生的![]() 、与OH-、Ba2+会发生反应产生BaCO3沉淀和H2O,不能大量共存,D不符合题意;
、与OH-、Ba2+会发生反应产生BaCO3沉淀和H2O,不能大量共存,D不符合题意;
故合理选项是A。
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户赵琳莉分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。