化学科学与社会活动密切相关。下述措施应积极推广的是
A.在抗击新冠肺炎疫情斗争中,提高环境友好无残留消毒剂的使用比例
B.原料药生产厂通过蒸发与焚烧过程,处理其生产废液
C.海边建筑工程施工,就近取海水海沙生产混凝土
D.为保证食物的口感与风味,增加食品添加剂使用品种与数量
A
【详解】
A. 使用环境友好无残留消毒剂,可以减少或杜绝污染,应该积极推广,故A正确;
B. 原料药生产厂生产的废液要集体利用物理、化学和生物的方法处理,不能蒸发和焚烧,故B错误;
C. 海边建筑工程施工,就近取海水海沙生产混凝土,会造成海洋生态环境的污染和破坏,故C错误;
D. 食品添加剂使用品种与数量都有严格的使用标准,不能随意增加,故D错误;
故选A。
古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液 C.常压蒸馏 D.浓缩结晶
D
【详解】
根据文中描述,将海水倒在锅中加热煮沸,看见白色的固体出现,这种白色的固体为盐,此过程涉及浓缩结晶的过程,故答案选D。
下列叙述正确的是
A.HClO 的结构式为H-Cl-O
B.核内有33个中子的Fe表示为![]() Fe
Fe
C.NH2OH的电子式为 
D.CH3CHO 的球棍模型为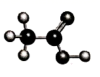
C
【详解】
A. HClO 的结构式为H-O-Cl,故A错误;
B. 核内有33个中子的Fe原子质量数为:33+26=59,表示为![]() Fe,故B错误;
Fe,故B错误;
C. NH2OH的电子式为 ,故C正确;
,故C正确;
D. CH3CHO 的球棍模型为 ,故D错误;
,故D错误;
正确答案是C。
实验室制备下列气体,能实现的是
A.Cl2:MnO2与稀HCl溶液混合 B.C2H4:CaC2与H2O混合
C.CO2:加热饱和NaHCO3溶液 D.SO2:Cu丝与稀H2SO4混合
C
【详解】
A.实验室制取氯气时利用二氧化锰和浓盐酸在加热的条件下制备,A错误;
B.碳化钙与水混合生成乙炔气体,不生成乙烯气体,B错误;
C.加热饱和碳酸氢钠溶液,50℃时易分解,分解成碳酸钠、二氧化碳和水,高温条件下气体在水中的溶解度较低,二氧化碳从水中溢出,可以用于制备二氧化碳,C正确;
D.铜与稀硫酸不发生反应,欲制备二氧化硫气体可以利用铜与浓硫酸在加热条件下的反应,D错误;
故选C。
下列说法错误的是
A.新榨油脂不及时干燥脱水易变质 B.聚氯乙烯可制作食品内包装材料
C.维生素C可作预包装食品抗氧剂 D.卤水点豆腐本质属于蛋白质聚沉
B
【详解】
A.新榨油脂若不及时干燥脱水,水中含有的微生物等物质可以将油脂氧化,使油脂变质,A正确;
B.聚氯乙烯为3类致癌物质,具有毒性,不可作为食品包装材料,B错误;
C.维生素C具有还原性,可作为预包装食品的抗氧化剂,C正确;
D.向豆浆中加入卤水,是豆浆中的蛋白质发生聚沉,属于蛋白质的聚沉,D正确;
故选B。
本卷还有14题,登录并加入会员即可免费使用哦~

该作品由: 用户谭汀分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。