燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气 C.液化石油气 D.氢气
D
【详解】
A.甲醇燃烧会产生CO2和水,CO2会导致温室效应;
B.天然气主要成分是CH4,燃烧会产生CO2和水,CO2会导致温室效应;
C.液化石油气主要成分是是各种液体烃,完全燃烧会产生CO2和水,CO2会导致温室效应;
D.氢气燃烧会产生水,不是污染物,故其中最环保的是氢气,选项D正确。
表示下列变化的化学用语中,正确的是( )
A.钢铁吸氧腐蚀的正极反应式:4OH--4e-=O2↑+2H2O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=+57.3kJ/mol
C.氯气和水反应的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.电解硫酸钠的阴极反应式:2H2O+2e-=H2↑+2OH-
D
【详解】
A. 钢铁吸氧腐蚀时,正极氧气得到电子发生还原反应,正极反应式:O2↑+2H2O+4e-=4OH-,A错误;
B. 中和反应是放热反应,NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,B错误;
C. 次氯酸是弱酸,氯气和水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO,C错误;
H++Cl-+HClO,C错误;
D. 电解硫酸钠时,阴极水电离产生的氢离子放电发生还原反应得到氢气,阴极反应式:2H2O+2e-=H2↑+2OH-,D正确;
答案选D。
反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B.
B.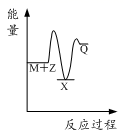
C. D.
D.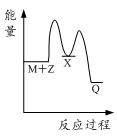
B
【分析】
根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题。
【详解】
由反应 M+Z→Q(△H>0)分两步进行 ①M+Z→X (△H<0)②X→Q(△H>0)可以看出:
(1)M+Z→Q(△H>0)是吸热反应,M和Z的能量之和小于Q,
(2)由①M+Z→X(△H<0)可知这步反应是放热反应,则M和Z的能量之和大于X,
(3)由②X→Q(△H>0)是吸热反应,故X的能量小于Q;
综上可知,X的能量小于M+Z;M+Z的能量小于Q,只有图象B符合。
答案选B。
下列说法正确的是( )
A.钢铁锈蚀时,Fe失去电子成为Fe3+
B.铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增加
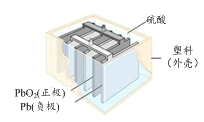
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铅蓄电池和碱性锌锰电池都属于二次电池
C
【详解】
A.钢铁锈蚀时,Fe作负极,铁失去电子生成Fe2+,A不正确;
B.铅蓄电池在放电过程中,负极Pb失电子后与电解质反应生成PbSO4,质量增大,B不正确;
C.将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,C正确;
D.碱性锌锰电池在放电后不能进行充电,属于一次电池,D不正确;
故选C。
一种可充电电池放电时的电极反应为H2-2e-+2OH-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。当电池充电时,与外接电源负极相连的电极上发生的反应是( )
A.H2被氧化 B.H2O被还原 C.Ni(OH)2被氧化 D.NiO(OH)被还原
B
【分析】
由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充电时H2是还原产物、NiO(OH)是氧化产物,与负极相连的是阴极极发生还原反应。
【详解】
充电池放电时发生H2-2e-+2OH-=2H2O,应为原电池的负极反应,氢气是还原剂被氧化,则充电时H2是还原产物,与负极相连的是阴极发生还原反应,则H2O被还原,
B符合题意。
答案选B。
本卷还有19题,登录并加入会员即可免费使用哦~

该作品由: 用户钟灼坚分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。