某NaOH固体中含有Na2CO3杂质。老师安排第一小组同学除去NaOH中的Na2CO3;第二小组同学测定固体混合物中的Na2CO3的质量分数。
Ⅰ.第一小组同学取一定量固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验,其中合理的是________。
甲:适量稀盐酸
乙:过量KOH溶液
丙:适量Ba(OH)2溶液
丁:适量CaCl2溶液
Ⅱ.第二组同学测定NaOH和Na2CO3混合物(质量为a g)中Na2CO3的质量分数的操作流程如下:
![]()
![]() 溶液
溶液 ![]() CaCO3
CaCO3![]() 质量为c g
质量为c g
(1)如果A是两种元素组成的盐,则A是________(填化学式)。
(2)B操作的名称是________,该操作中用到的玻璃仪器是________。实验要求加入的A溶液必须过量,以保证反应物完全进行。检查原溶液中被反应对象已经反应完的方法是_____。
(3)实验中洗涤碳酸钙沉淀的方法是________。检验沉淀已经洗涤干净的方法是___________。
(4)混合物中Na2CO3的质量分数为______________用a、c的代数式表示)。
丙 CaCl2 过滤 漏斗、玻璃棒、烧杯 向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完 沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次 取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净 ![]() %
%
【解析】
Ⅰ.根据除杂的原则分析判断;
Ⅱ. (1)加入A溶液的目的是使碳酸钠转化为碳酸钙沉淀,据此分析判断;
(2)B操作是从溶液中分离出碳酸钙沉淀,据此分析解答;检查碳酸钠反应完可以检查溶液中没有了碳酸钠,据此分析解答;
(3)根据洗涤沉淀的一般方法解答。碳酸钙沉淀上吸附有氢氧化钠和氯化钠,检验沉淀洗涤干净可以检验氯离子,据此分析解答;
(4) 根据Na2CO3+ CaCl2= CaCO3↓+ 2NaCl分析计算。
【详解】
Ⅰ. 甲.适量稀盐酸与氢氧化钠和碳酸钠均能反应,将氢氧化钠也除去了,故错误;乙.过量KOH溶液与氢氧化钠和碳酸钠均不能发生复分解反应,故错误;丙.适量Ba(OH)2溶液与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,能够达到除去NaOH固体中含有Na2CO3杂质的目的,故正确;丁.适量CaCl2溶液与碳酸钠反应生成了碳酸钙沉淀和氯化钠,引入了新杂质,故错误;故答案为丙;
Ⅱ. (1)加入A溶液的目的是使碳酸钠转化为碳酸钙沉淀,如果A是两种元素组成的盐,则A是氯化钙,故答案为CaCl2;
(2)B操作是从溶液中分离出碳酸钙沉淀,故B操作为过滤;过滤操作中用到的玻璃仪器有漏斗、玻璃棒、烧杯;实验要求加入的A溶液必须过量,以保证反应物完全进行。检查碳酸钠反应完的方法是向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完,故答案为过滤;漏斗、玻璃棒、烧杯;向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完;
(3)洗涤碳酸钙沉淀的方法为沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次。碳酸钙沉淀上吸附有氢氧化钠和氯化钠,检验沉淀洗涤干净可以检验氯离子,方法为取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净,故答案为沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次;取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净;
(4) Na2CO3+ CaCl2= CaCO3↓+ 2NaCl
106 100
m(Na2CO3) c g
![]() =
=![]() ,解得:m(Na2CO3)=
,解得:m(Na2CO3)= ![]() cg,混合物中Na2CO3的质量分数=
cg,混合物中Na2CO3的质量分数=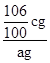 ×100%=
×100%=![]() %,故答案为
%,故答案为![]() %。
%。
为了测定由NaCl和Na2SO4组成混合物中Na2SO4的质量分数,某同学设计了如下实验步骤:①称取a克样品,加水溶解;②加入过量试剂A;③将所得的沉淀过滤、洗涤、干燥;④称量所得沉淀的质量为b克。
请回答下列问题:
(1)所选择的试剂A最好是________(请从下列选项中选择)。
A.AgNO3 B.BaCl2 C.CaCl2 D.前三种都不好
(2)试剂A必须过量,以保证反应物完全沉淀。判断试剂A已经过量的方法是________。
(3)实验过程中洗涤沉淀的方法是________(请从下列选项中选择)。
A.将滤纸上的沉淀转移至烧杯中,加水后用玻璃棒充分搅拌,然后再次过滤
B.直接在过滤器中加水淋洗,并用玻璃棒不断搅拌,静置,重复此操作三次
C.向置于过滤器上的沉淀加蒸馏水至完全淹没,静置,重复此操作三次
(4)实验过程中判断沉淀已经洗涤干净的方法是___________________________。
(5)根据上述数据计算Na2SO4的质量分数为______(用a、b表示)。
B 加入一定量的BaCl2后,静置,在上层清液中继续加入BaCl2溶液,若没有白色沉淀产生,证明所加BaCl2已过量,反应物已完全沉淀 C 取少量洗涤液于试管中,加入适量的硝酸银溶液,如果没有沉淀产生,说明已经洗涤干净 ![]() ×100%
×100%
【分析】
(1)A.AgNO3既可与NaCl反应生成AgCl沉淀,又可与(NH4)2SO4反应生成微溶的Ag2SO4;B.氯化钡只与硫酸钠反应形成沉淀;C.氯化钙与硫酸钠反应形成微溶性的硫酸钙,结合实验目的分析判断;
(2)具有试剂A(BaCl2)是否过量,只需要检验溶液中是否有没有沉淀的硫酸根离子即可;
(3)根据洗涤沉淀的一般方法解答;
(4)实验过程中生成沉淀后溶液中存在氯化钠和过量的氯化钡,因此判断沉淀是否已经洗涤干净只需要判断洗涤后的液体中是否存在氯离子即可;
(5)根据Na2SO4+CaCl2=2NaCl+BaSO4↓分析计算。
【详解】
(1)A.AgNO3既可与NaCl反应生成AgCl沉淀,又可与(NH4)2SO4反应生成微溶的Ag2SO4,微溶性的硫酸银不能保证硫酸钠完全被转化为沉淀,也就无法定量表示出硫酸钠的量,硝酸银无法完成要求;B.氯化钡只与硫酸钠反应形成沉淀,通过测量硫酸钡沉淀质量就可获知硫酸钠的质量,氯化钡满足测定要求;C.氯化钙与硫酸钠反应形成硫酸钙,但硫酸钙是微溶性物质,过滤得到的沉淀质量并不一定能表示所有硫酸钠的质量,氯化钙不满足要求;故答案为B;
(2)试剂A(BaCl2)必须过量,以保证反应物完全沉淀。判断试剂A已经过量,只需要检验溶液中是否有没有沉淀的硫酸根离子即可,方法为:加入一定量的BaCl2后,静置,在上层清液中继续加入BaCl2溶液,若没有白色沉淀产生,证明所加BaCl2已过量,反应物已完全沉淀,故答案为加入一定量的BaCl2后,静置,在上层清液中继续加入BaCl2溶液,若没有白色沉淀产生,证明所加BaCl2已过量,反应物已完全沉淀;
(3)实验过程中洗涤沉淀的方法为:向置于过滤器上的沉淀加蒸馏水至完全淹没,静置,重复此操作二~三次,故答案为C;
(4)实验过程中生成沉淀后溶液中存在氯化钠和过量的氯化钡,因此判断沉淀是否已经洗涤干净只需要判断洗涤后的液体中是否存在氯离子即可,方法为:取少量洗涤液于试管中,加入适量的硝酸银溶液,如果没有沉淀产生,说明已经洗涤干净,故答案为取少量洗涤液于试管中,加入适量的硝酸银溶液,如果没有沉淀产生,说明已经洗涤干净;
(5)Na2SO4+CaCl2=2NaCl+BaSO4↓
142 233
x b g
x=![]() g,硫酸钠的质量分数为
g,硫酸钠的质量分数为![]() ×100%,故答案为
×100%,故答案为![]() ×100%。
×100%。
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
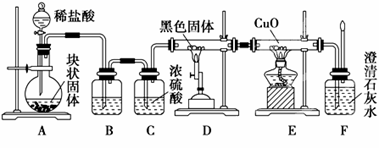
(1)写出装置A中发生反应的离子方程式:______________________________。
(2)装置B中最适宜的试剂是______.
(3)装置D中黑色固体为_______(填名称),反应的化学方程式为:_________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: __________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是 _____________。
(6)根据实验中的______现象,可证明CO具有还原性,有关反应的化学方程式是____________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置_______与_____之间连接下图中的________装置(填序号)。
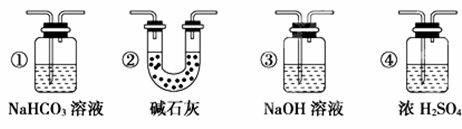
CaCO3+2H+=Ca2++H2O+CO2↑; 饱和碳酸氢钠溶液 碳 C+CO2![]() 2CO 没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO,从而干扰对CO还原性的验证 检查装置的气密性 E装置中黑色CuO变成红色 CO+CuO
2CO 没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO,从而干扰对CO还原性的验证 检查装置的气密性 E装置中黑色CuO变成红色 CO+CuO![]() Cu+CO2 D E ②
Cu+CO2 D E ②
【解析】
本题是探究CO还原性的实验设计题,利用C和CO2反应生成的CO还原氧化铜,结合氧化铜变红色粉末和石灰水变浑浊来推测CO的还原性,但因CO2中混有的水蒸气也能和C反应生成CO和H2,生成的H2有还原性对实验有干扰,因此CO2必须干燥处理,据此分析可作答。
【详解】
(1)装置A中是盐酸和石灰石反应生成二氧化碳、氯化钙和水,其反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
(2)实验室用盐酸和石灰石制取二氧化碳,该反应放出的热量导致盐酸挥发,所以制取的二氧化碳中含有氯化氢气体,为除去氯化氢气体,选取的试剂应能除去氯化氢气体且不和二氧化碳反应,则只能选取可溶性碳酸氢盐的饱和溶液,一般常用饱和的碳酸氢钠溶液;
(3)选择C和CO2反应生成CO,因此装置D中黑色固体为碳,反应的方程式为C+CO2![]() 2CO;
2CO;
(4)实验中没有装置C,使装置B与装置D直接相连,则CO2中混有的水蒸气会与碳反应生成还原性的H2,影响CO还原性的判断,因此对实验造成的影响是没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO,从而干扰对CO还原性的验;
(5)实验前,需对整套装置进行气密性检验;
(6)利用E装置中的黑色氧化铜变为红色,可知道氧化铜被还原为铜,推测CO具有还原性,反应的方程式为CO+CuO![]() Cu+CO2;
Cu+CO2;
(7)和二氧化碳的反应中,二氧化碳不可能完全转化为一氧化碳,所以从D装置出来的气体中含有二氧化碳,为防止原来二氧化碳的干扰,应先把D出来的二氧化碳除去,再将一氧化碳气体通过E装置,二氧化碳是酸性氧化物,所以用碱性物质除去,所以在D和E之间连接②。
如图A是某粒子的结构示意图,B是铝元素在周期表中的信息。
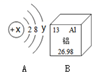
(1)若A粒子带有两个单位的负电荷,且y等于8,则该粒子的符号为___。
(2)当x=17时,A元素和B元素形成的化合物的化学式为___。
(3)B元素的单质在空气中能生成致密的___(化学式)薄膜。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有某些相似的结构和性质。下列各组粒子中等电子体的是____(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43-和SO42-
S2- AlCl3 Al2O3 BD
【分析】
(1)根据粒子中核内质子数和核外电子数之间的关系解答;
(2)根据结构示意图及化学式的写法解答;
(3)根据B是铝元素,B元素的单质在空气中能生成致密的氧化铝薄膜解答;
(4)根据等电子体在计算时,是将组成的各原子的电子数相加所得的和解答。
【详解】
(1)若A粒子带有两个单位的负电荷,且y 等于8,说明得到两个电子,则x=2+8+6=16,该粒子为硫离子,符号为S2−,故答案为S2-;
(2)当x=17时,A元素是氯元素,与金属形成化合物时显−1价,B是铝元素,化合价是+3价,化合物的化学式为AlCl3,故答案为AlCl3;
(3)B是铝元素,B元素的单质在空气中能生成致密的氧化铝薄膜,化学式为:Al2O3;
(4)A. NO的质子数为7+8=15,O2的质子数为8×2=16,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体,A项错误;
B. CO的质子数为6+8=14,N2的质子数为7×2=14,分子中质子数等于电子数,且两者的分子中含有的原子个数都是2,所以两者是等电子体,B项正确;
C. SO2的质子数为16+8×2=32, CO2的质子数为6+8×2=22,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体,C项错误;
D. 一个PO43−离子中有5个原子,有15+8×4+3=50个电子,一个SO42-离子中有5个原子,有16+8×4+2=50个电子,所以这两种离子是等电子体,D项正确;
故答案为BD。
下列含氯的化合物:①HClO ②Cl2 ③NaCl ④KClO3 ⑤HClO4,按氯元素的化合价由高到低的顺序排列为(填序号)_______________________________________。
⑤④①②③
【解析】
氢元素显+1价,氧元素显−2价,设HClO中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(−2)=0,则x=+1价;
根据单质中元素的化合价为0,Cl2属于单质,故氯元素的化合价为0;
钠元素显+1价,设NaCl中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y=0,则y=−1价;
钾元素显+1价,氧元素显−2价,设KClO3中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+z+(−2)×3=0,则z=+5价;
氢元素显+1价,氧元素显−2价,设HClO4中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)+w+(−2)×4=0,则w=+7价;
因此氯元素的化合价由高到低的顺序排列为⑤④①②③。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户黎心分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。