25℃时,向物质的量浓度相等的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
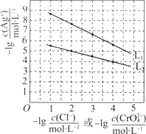
A.Ksp(AgCl)的数量级为10-12
B.L1为Na2CrO4溶液中滴加AgNO3溶液时离子浓度关系曲线
C.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4作指示剂
D.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
C
【解析】
由![]() ,则
,则![]() ,因
,因![]() ,则
,则![]() ,故斜率较大的为
,故斜率较大的为![]() 溶液中滴加
溶液中滴加![]() 溶液时离子浓度关系曲线,即为
溶液时离子浓度关系曲线,即为![]() 。
。
【详解】
A.![]() 为NaCl溶液中滴加
为NaCl溶液中滴加![]() 溶液时离子浓度关系曲线,当
溶液时离子浓度关系曲线,当![]() 时,
时,![]() ,此时
,此时![]() 约为
约为![]() ,则
,则![]() ,故K
,故K![]() ,数量级为
,数量级为![]() ,故A错误;
,故A错误;
B.![]() 为NaCl溶液中滴加
为NaCl溶液中滴加![]() 溶液时离子浓度关系曲线,故B错误;
溶液时离子浓度关系曲线,故B错误;
C.通过图像对比发现:![]() 先与
先与![]() 生成沉淀,当氯离子浓度低于
生成沉淀,当氯离子浓度低于![]() 后,
后,![]() 才会与
才会与![]() 结合生成砖红色沉淀,则用
结合生成砖红色沉淀,则用![]() 标准溶液测定溶液中
标准溶液测定溶液中![]() 含量时可用
含量时可用![]() 作指示剂,故C正确;
作指示剂,故C正确;
D.![]() 和
和![]() 交点处对应的两种溶液中铬酸根离子浓度与氯离子浓度相等,但银离子的浓度与其不相等,故D错误。
交点处对应的两种溶液中铬酸根离子浓度与氯离子浓度相等,但银离子的浓度与其不相等,故D错误。
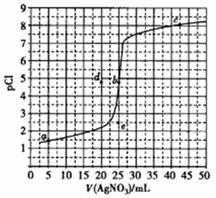
已知:ZnS呈白色,CuS呈黑色;常温下,Ksp(ZnS)=3.0×10-25,Ksp(CuS)=1.0×10-36;pM=-lgc(M2+)。常温下,向10.0mL0.20mol•L-1ZnCl2溶液中逐滴滴加0.10mol•L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法不正确的是( )

A.V0=20.0mL,m=12.5-![]() lg3
lg3
B.相同实验条件下,若用10.0mL0.20mol•L-1CuCl2溶液代替上述ZnCl2溶液,则反应终点b向d方向移动
C.若c(ZnCl2)=0.10mol•L-1,则反应终点可能为e点
D.向b点浊液中加入0.002molCuCl2固体,白色沉淀变黑色
C
【详解】
A.根据待测液和滴加溶液的浓度可知,b是滴定终点,![]() ,
,![]() ,故A正确;
,故A正确;
B.因为硫化铜的溶度积小于硫化锌,因此滴定终点时,在硫化铜饱和溶液中铜离子浓度小于锌离子,![]() ,因此,pM会更大,故反应终点b向d方向移动,故B正确;
,因此,pM会更大,故反应终点b向d方向移动,故B正确;
C.若![]() ,则反应终点消耗硫化钠为10mL,pM不变,因此反应终点可能为a点,故 C错误;
,则反应终点消耗硫化钠为10mL,pM不变,因此反应终点可能为a点,故 C错误;
D.因为硫化铜的溶度积远小于硫化锌,所以向硫化锌饱和溶液中加![]() 固体,硫化锌白色沉淀转化为硫化铜黑色沉淀,故D正确。
固体,硫化锌白色沉淀转化为硫化铜黑色沉淀,故D正确。
【点睛】
溶度积越大,难溶物越溶;溶度积大的难溶物可以转化为溶度积小的难溶物。
室温时,用0.100mol· L -1AgNO3溶液滴定50.0mL0.0500mol· L -1NaCl溶液的滴定曲线如图所示[pCl=-lg(Cl-)]。下列有关描述错误的是
A.室温时Ksp(AgCl)的数量级为10-10
B.室温时,各点Ksp(AgCl)的关系:a=b=c
C.相同实验条件下,若改用0.0400mol· L-1 NaCl溶液,反应终点b移动到d
D.相同实验条件下,若改用0.0500mol· L-1 NaBr溶液,反应终点b向e方向移动
D
【详解】
A.选取横坐标为50mL的点,此时向50.0mL0.0500mol· L -1NaCl溶液中,加入50mL 0.100mol· L -1AgNO3溶液,可计算出此时溶液中过量的Ag+浓度为0.025 mol· L -1,由图示得到此时Cl—约为1×10-8 mol· L -1,所以Ksp(AgCl)约为0.025×10-8=2.5×10-10,所以其数量级为10-10,故A正确;
B.由于Ksp(AgCl)极小,因此向溶液中滴加AgNO3溶液就会有沉淀析出,溶液一直是氯化银的饱和溶液,在一定温度时,,Ksp(AgCl)是个常数,故各点Ksp(AgCl)的关系:a=b=c,故B正确;
C. 滴定的过程是用硝酸银滴定NaCl溶液,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的NaCl溶液改为50m L 0.0400mol. L-1的NaCl溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由b点的25mL变为25×0.8=20mL,而d点对应的是20 mL,故C正确;
D. 卤化银从氯化银到碘化银的溶解度逐渐减小,所以Ksp(AgCl)应该大于Ksp(AgBr),将50mL 0.0500mol/L的NaCl溶液改为50m L 0.0500mol/LNaBr的溶液,这是将溶液中的氯离子换为等物质的量的溴离子,因为银离子和氯离子或溴离子都是1:1沉淀的,所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,溴离子的浓度应该比终点时氯离子的浓度更小,所以反应终点不可能b向e方向移动,故D错误;
故选D。
某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
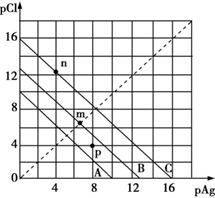
A.A线、B线、C线对应的温度关系:A>B>C
B.A线对应温度下,AgCl的Ksp=1×10-10
C.B线对应温度下,p点形成的溶液是AgCl的不饱和溶液
D.C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀
C
【解析】
A、pAg=-lgc(Ag+),pCl=-lgc(Cl-),pAg、pCl越大,其对应的c(Ag+)、c(Cl-)越小,AgCl的Ksp越小,对应的温度越低,故A线、B线、C线对应的温度关系为A>B>C,A正确;
B、根据题图知,A线对应温度下,pAg=4时,pCl=6,即c(Ag+)=1×10-4 mol·L-1时,c(Cl-)=1×10-6 mol·L-1,则A线对应温度下,AgCl的Ksp=1×10-4×1×10-6=1×10-10,B正确;
C、B线对应温度下,p点在曲线的下方,形成的溶液为AgCl的过饱和溶液,C错误;
D、n点对应的pAg<pCl,则c(Ag+)>c(Cl-),故n点表示在C线对应温度下,KCl与过量的AgNO3反应产生AgCl沉淀,D正确。
答案选C。
某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
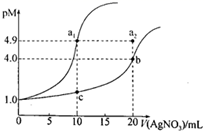
A.该温度下,Ksp(Ag2CrO4)=4×10-12
B.al、b、c三点所示溶液中c(Ag+):al>b>c
C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
B
【分析】
根据pM=-lgc(Cl-)或pM=-lgc(CrO42-)可知,c(CrO42-)越小,pM越大,根据图像,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。当滴加10 mL0.1 mol·L-lAgNO3溶液时,氯化钠恰好反应,滴加20 mL0.1 mol·L-lAgNO3溶液时,K2CrO4恰好反应,因此al所在曲线为氯化钠,b、c所在曲线为K2CrO4,据此分析解答。
【详解】
A.b点时恰好反应生成Ag2CrO4,-lgc(CrO42-)=4.0,c(CrO42-)= 10-4mol·L-l,则c(Ag+)=2× 10-4mol·L-l,该温度下,Ksp(Ag2CrO4)=c(CrO42-)×c2(Ag+)=4×10-12,故A正确;
B.al点恰好反应,-lgc(Cl-)=4.9,c(Cl-)=10-4.9mol·L-l,则c(Ag+)=10-4.9mol·L-l,b点c(Ag+)=2× 10-4mol·L-l,c点,K2CrO4过量,c(CrO42-)约为原来的![]() ,则c(CrO42-)= 0.025mol·L-l,则c(Ag+)=
,则c(CrO42-)= 0.025mol·L-l,则c(Ag+)=![]() =
=![]() ×10-5mol·L-l,al、b、c三点所示溶液中b点的c(Ag+)最大,故B错误;
×10-5mol·L-l,al、b、c三点所示溶液中b点的c(Ag+)最大,故B错误;
C.温度不变,氯化银的溶度积不变,若将上述NaCl溶液浓度改为0.2mol·L-1,平衡时,-lgc(Cl-)=4.9,但需要的硝酸银溶液的体积变成原来的2倍,因此a1点会平移至a2点,故C正确;
D.根据上述分析,当溶液中同时存在Cl-和CrO42-时,加入硝酸银溶液,Cl-先沉淀,用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂,滴定至终点时,会生成Ag2CrO4为红棕色沉淀,故D正确;
答案选B。
本卷还有20题,登录并加入会员即可免费使用哦~

该作品由: 用户叶磊分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。