我国科学家成功合成了含N![]() 的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
(1)N在元素周期表中的位置是______。
(2)N![]() 中,N原子之间的相互作用是______(填“离子键”或“共价键”)。
中,N原子之间的相互作用是______(填“离子键”或“共价键”)。
(3)非金属性O强于N,用原子结构解释原因:______,得电子能力O大于N。
(4)砷(As)与氮位于同一主族,下列推断正确的是______(填序号)。
① 砷元素的最低负化合价为−3价 ② 热稳定性:AsH3>NH3 ③ 砷的最高价氧化物对应的水化物属于酸
第2周期、第VA族 共价键 电子层数O与N相同,核电荷数O大于N,原子半径O小于N ① ③
【解析】
(1)氮元素的原子序数为7,位于元素周期表第二周期VA族;
(2)氮元素是非金属元素,非金属元素的原子之间通过共用电子对形成共价键;
(3)氮原子和氧原子的电子层数相同,氧元素的核电荷数大于氮元素,氧原子的半径小于氮原子,氧原子得到电子的能力强于氮原子;
(4)同主族元素,最外层电子数相同,结构相似,性质相似,从上到下原子半径依次增大,非金属性依次减弱。
【详解】
(1)氮元素的原子序数为7,位于元素周期表第二周期VA族,故答案为:第二周期VA族;
(2)氮元素是非金属元素,N5—离子中,氮原子和氮原子之间通过共用电子对形成共价键,故答案为:共价键;
(3)氮原子和氧原子的电子层数相同,氧元素的核电荷数大于氮元素,氧原子的半径小于氮原子,氧原子得到电子的能力强于氮原子,则氧元素的非金属性强于氮元素,故答案为:电子层数O与N相同,核电荷数O大于N,原子半径O小于N;
(4)①同主族元素,最外层电子数相同,性质相似,氮元素的最低负化合价为−3价,则同主族的砷元素的最低负化合价也为−3价,故正确;
②同主族元素,从上到下非金属性依次减弱,氢化物的热稳定性依次减小,则热稳定性NH3>AsH3,故错误;
③砷元素是非金属元素,最高价氧化物对应的水化物是H3AsO4,H3AsO4属于酸,故正确;
①③正确,故答案为:①③。
【点睛】
氮元素是非金属元素,非金属元素的原子之间通过共用电子对形成共价键是解答关键。
化学电池的发明,是贮能和供能技术的巨大进步。

(1)如图所示装置中,Cu片是______(填“正极”或“负极”)。
(2)如图所示装置可将______(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是______。

(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是______(填序号)。
① A为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动
正极 Zn + H2SO4 =ZnSO4 + H2↑ 电流表指针偏转,铜片上有气泡产生 ② ③
【解析】
(1)如图所示装置为原电池装置,锌失电子作负极,Cu作正极;
(2)原电池装置为将化学能转化为电能的装置;
(3)根据电子的移动方向,判断A为负极,B为正极,溶液中的锂离子向正极移动。
【详解】
(1)如图所示装置中,锌失电子作负极,则Cu作正极;
(2)电池总反应式为锌与硫酸反应生成硫酸锌和氢气,反应释放的能量转化为电能,方程式为Zn + H2SO4 =ZnSO4+ H2↑;当有电流通过时,电流计的指针发生偏转,且铜电极的表面有气泡生成;
(3)①根据电子的流向,A为电池的负极,①说法错误;
②该装置为原电池装置,实现了化学能转化为电能,②说法正确;
③根据图像,电池工作时,电池内部的锂离子向正极移动,发生定向移动,③说法正确;
答案为②③。
选择完成下列实验的装置。
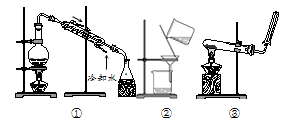
(1)除去粗盐水中的泥沙用______(填序号,下同)。
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用______。
(3)自来水制备蒸馏水用______。
② ③ ①
【解析】
(1)除去粗盐水中的泥沙用可使用过滤操作,答案选②;
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,应选用固固加热装置,答案选③;
(3)自来水制备蒸馏水应选择蒸馏装置,答案选①。
阅读短文,回答问题。
2019年10月1日上午,庆祝中华人民共和国成立70周年活动在北京天安门广场隆重举行,场面震撼、激动人心。活动践行了环保理念。


庆祝活动伊始,56门礼炮交替鸣放70响,礼炮弹药燃烧后几乎没有留下灰渣,近乎零污染。
活动中使用的约2.4万平方米红地毯,是以40余万个废旧矿泉水瓶为主要原料生产的。
飞机使用的新型“航空液体彩色拉烟剂”,其研制生产中选用了环保无毒的染色材料。
广场上放飞了7万个充氦气的气球,这些气球都是由可降解的材料制成的。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)礼炮弹药的燃烧属于化学变化______。
(2)废旧矿泉水瓶可以回收再利用______。
(3)“航空液体彩色拉烟剂”的研制生产选用了环保无毒的染色材料______。
(4)用氦气填充气球的原因是氦气密度比空气的大、性质稳定______。
对 对 对 错
【解析】
(1)礼炮弹药燃烧的过程中有新物质生成;
(2)在垃圾分类的标准中,废旧矿泉水瓶属于可回收物;
(3)由题意可知航空液体彩色拉烟剂的研制生产选用的是环保无毒的染色材料;
(4)氦气的相对分子质量小于空气的平均相对分子质量,密度比空气小。
【详解】
(1)礼炮弹药燃烧的过程中有新物质生成,属于化学变化,该说法正确,故答案为:对;
(2)在垃圾分类的标准中,废旧矿泉水瓶属于可回收物,由题意可知废旧矿泉水瓶可以制作红地毯,是可以回收再利用,该说法正确,故答案为:对;
(3)由题意可知航空液体彩色拉烟剂的研制生产选用的是环保无毒的染色材料,该说法正确,故答案为:对;
(4)氦气是性质稳定的稀有气体,相对分子质量小于空气的平均相对分子质量,密度比空气小,则用氦气填充气球的原因是氦气密度比空气的大、性质稳定的说法错误,故答案为:错。
【点睛】
氦气是性质稳定的稀有气体,相对分子质量小于空气的平均相对分子质量,密度比空气小是解答关键。
化工厂用浓氨水检验氯气管道是否漏气,利用的反应为:8NH3 + 3Cl2 =N2 + 6NH4Cl
(1)作还原剂的物质是_____,氯元素的化合价_____(填“升高”或“降低”)。
(2)若反应中每生成 6 mol NH4Cl,则消耗Cl2 的物质的量至少为_____mol,转移电子的物质的量为_____mol。
NH3 降低 3 6
【解析】
根据所给的化学方程式分析,方程式中N元素化合价升高,Cl元素化合价降低。
【详解】
(1)方程式中N元素化合价升高,为还原剂,故作还原剂的物质是NH3;Cl元素从0价变成-1价化合价降低;
(2)根据方程式的化学计量数可知,每生成6mol NH4Cl,消耗Cl2的物质的量至少为3mol,转移电子数为6mol。
本卷还有29题,登录并加入会员即可免费使用哦~

该作品由: 用户刘然分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。