PBAT(聚已二酸/对苯二甲酸丁二酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物 PBA 和PBT 共聚制得,一种合成路线如下:

已知:R-CH3![]() R-CN
R-CN![]() R-COOH
R-COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)B 的官能团名称为_____,D 的分子式为_____。
(2)①的反应类型为_____;反应②所需的试剂和条件是_____。
(3)H 的结构简式为_____。
(4)⑤的化学方程式为_____。
(5)M 与G 互为同系物,M 的相对分子质量比G 大 14;N 是 M 的同分异构体,写出同时满足以下条件的N 的结构简式:______________(写两种,不考虑立体异构)。
Ⅰ.既能与 FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ.与 NaOH 溶液反应时,1mol N 能消耗 4molNaOH;
Ⅲ.核磁共振氢谱有五组峰,峰面积比为 1:2:2:2:1。
(1). 氯原子 (2). C6H10O4 (3). 取代反应 (4). NaOH、C2H5OH(或乙醇),加热 (5). HOCH2CH2CH2CH2OH (6). ![]() +2NH3+3O2→
+2NH3+3O2→![]() +6H2O (7).
+6H2O (7). 
【解析】
从A到C由环烷烃变成了环烯烃,并且A生成B是光照下与Cl2的取代,所以从B到C即为卤代烃的消去,结合题干提示的反应,环己烯经过高锰酸钾处理后就可以得到己二酸,H就是1,4-丁二醇,所以PBA就是聚己二酸丁二酯。从E生成F,再由F生成对苯二甲酸,条件恰好与题干提示的反应相同,所以推测E为对二甲苯,F即为对苯二腈。
【详解】(1)B为卤代烃,官能团的名称为氯原子;D为己二酸,所以分子式为C6H10O4;
(2)反应①即为烃变成卤代烃的反应,反应类型即为取代反应;反应②为卤代烃的消去反应,所加试剂即NaOH,乙醇,并且需要加热;
(3)H通过推断即为1,4-丁二醇,所以结构简式为HOCH2CH2CH2CH2OH;
(4)反应⑤即由对二甲苯生成对苯二腈的反应,所以方程式为:![]() +2NH3+3O2→
+2NH3+3O2→![]() +6H2O;
+6H2O;
(5)由题可知M的分子式为C9H8O4,扣除苯环还有2个不饱和度;满足要求的N的结构中一定有羟基,此外也要具有醛基和酯基的结构;考虑到1molN能消耗4mol的NaOH,所以只能是2个羟基,1个甲酸酯基,由于还需要有一个不饱和度,所以还含有一个乙烯基;再考虑到核磁共振氢谱的信息,最终满足要求的有机物的结构为如下两种: ;
;
【点睛】书写满足特定要求的物质的同分异构体的结构时,从不饱和度入手,结合有关信息确定有机物中一定含有的结构;此外,也要注意特定结构的基团,例如甲酸酯基等;确定有机物所含的基团后,再结合核磁共振氢谱的信息考虑物质的对称性,最终将物质的结构书写出来。
铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
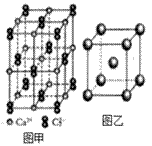
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
(1). 第四周期 Ⅷ族 (2). [Ar]3d5或1s22s22p63s23p63d5 (3). AB (4). K<C<O<N (5). sp sp2 (6). 2:1 (7). 4 (8). 分子 (9). ![]()
【解析】
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,据此确定其在周期表的位置;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①KCNO由K、C. N、O四种元素组成,K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低;
②丙烯腈(H2C=CH−C≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,C−H都是σ键,确定分子中σ键和π键数目,再求出比值;
(4)1个Ca2+周围距离最近且等距离的C22−应位于同一平面,注意使晶胞沿一个方向拉长的特点;
(5)Fe(CO)5的熔点、沸点均不高,类似于分子晶体的特点;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() ,晶胞体积V=
,晶胞体积V=![]() cm3、边长a=
cm3、边长a=![]() cm,根据Fe原子半径r与晶胞边长a关系求出r。
cm,根据Fe原子半径r与晶胞边长a关系求出r。
【详解】(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,位于第四周期Ⅷ族据;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为) [Ar]3d5或1s22s22p63s23p63d5故答案为:第四周期Ⅷ族,[Ar]3d5或[Ar]3d5或1s22s22p63s23p63d5;
(2)[Fe(CN)6]3−是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用力,不是化学键,故选AB;故答案为:AB;
(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为K<C<O<N;故答案为:K<C<O<N;
②丙烯腈(H2C=CH−C≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,C−H都是σ键,所以分子中σ键和π键数目分别为6、3,σ键和π键数目之比为6:3=2:1;故答案为:sp、sp2;2:1;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22−不是6个,而是4个,故答案为:4;
(5)根据Fe(CO)5的熔点、沸点均不高的特点,可推知Fe(CO)5为分子晶体;故答案为:分子;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() ,晶胞体积
,晶胞体积![]() 、边长
、边长![]() cm,Fe原子半径r与晶胞边长a关系为4r=
cm,Fe原子半径r与晶胞边长a关系为4r=![]() a,所以
a,所以![]() ;故答案为:
;故答案为: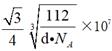 。
。
对甲烷和 CO2 的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合 CO2 重整反应有:
反应(i):2CH4(g)+O2(g)⇌2CO(g)+4H2(g) △ H=-71.4kJ•mol-1
反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g) △ H=+247.0 kJ•mol-1
(1)写出表示 CO 燃烧热的热化学方程式:_____。
(2)在两个体积均为 2L 的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
| 容器 | 起始物质的量(n) / mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列条件能说明反应达到平衡状态的是_____。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内 CO 的物质的量的关系满足:2n(CO)Ⅰ_____n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下, 相同时间内测得 CH4 转化率与温度变化关系如图所示。c 点_____(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____。

(4)CO2 也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ∆H<0。设 m 为起始时的投料比,即 m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1 图2
图2 图3
图3
①图 1 中投料比相同,温度从高到低的顺序为_________。
②图 2 中 m1、m2、m3 从大到小的顺序为_________。
③图 3 表示在总压为 5 MPa 的恒压条件下,且 m=3 时,平衡状态时各物质的物质的量分数与温度的关系。T4 温度时,该反应压强平衡常数KP的计算式为_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
(1). CO(g)+![]() O2(g)=CO2(g) △ H=-282.7kJ•mol-1 (2). C (3). > (4). 一定未 (5). 催化剂不会影响平衡转化率,在相同条件下,乙催化剂对应的 c 点的转化率没有甲催化剂对应的 b 点的转化率高,所以 c 点一定未平衡 (6). T3>T2>T1 (7). m1>m2>m3 (8).
O2(g)=CO2(g) △ H=-282.7kJ•mol-1 (2). C (3). > (4). 一定未 (5). 催化剂不会影响平衡转化率,在相同条件下,乙催化剂对应的 c 点的转化率没有甲催化剂对应的 b 点的转化率高,所以 c 点一定未平衡 (6). T3>T2>T1 (7). m1>m2>m3 (8). ![]()
【解析】(1)书写燃烧热的热化学方程式,一定要保证:可燃物的化学计量系数为1;可燃物发生完全燃烧;生成产物是在常温常压下稳定存在的物质,根据盖斯定律可得:![]()
![]() ;
;
(2) ①A.2v正(CH4) =v逆(CO)时,反应才达到平衡状态,A项错误;
B.由于平衡常数未知,所以浓度满足上式不一定处于平衡状态,B项错误;
C.由于该反应是在恒温恒容条件下进行的,且属于非等体积反应,根据公式![]() 可知,当压强不变,该反应一定达到平衡,C项正确;
可知,当压强不变,该反应一定达到平衡,C项正确;
D.由于该反应是在恒温恒容条件下进行的,且全为气体参与,根据公式![]() 可知,密度恒定与平衡状态无关,D项错误;
可知,密度恒定与平衡状态无关,D项错误;
答案选C。
②构造容器Ⅲ:除起始物质只加入0.2molCH4和0.2molCO2外,其他条件与Ⅰ、Ⅱ相同;通过分析可知容器Ⅱ、Ⅲ中的平衡等效。容器Ⅲ相比于容器Ⅰ,进料增加了一倍,考虑到反应方程式,所以Ⅲ相比于Ⅰ,平衡逆移,CO的含量下降,所以2n(CO)Ⅰ>n(CO)Ⅱ;
(3)催化剂对于平衡无影响,相同条件下,加入甲催化剂达到的转化率b高于加入乙催化剂的转化率c,所以c点对应的一定不是平衡状态;
(4) ①由于该反应放热,所以温度越高反应物转化率越低,所以T3>T2>T1;
②对于两种反应物的反应,增加其中一种物质的投料,会使另一种物质的转化率提高,所以m1>m2>m3;
③由于投料按照化学计量系数比进行,所以反应任意时刻,n(H2):n(CO2)=3:1,且n(乙醇):n(水)=1:3;所以图中c线为H2,d线为CO2,a线为水,b线为乙醇;结合数据可知,T4时,平衡状态时,H2含量为0.375,CO2为0.125,水为0.375,乙醇为0.125。所以压强平衡常数的表达式为:![]() 。
。
某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:

已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
| 开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
| 沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。

(1). BaSO4和SiO2 (2). ![]() (3). 3.7<pH<7.2 (4). 分液漏斗 (5).
(3). 3.7<pH<7.2 (4). 分液漏斗 (5). ![]() (6). 蒸发浓缩 (7). 冷却结晶 (8). 三氧化二镍
(6). 蒸发浓缩 (7). 冷却结晶 (8). 三氧化二镍
【解析】
原料的成分含有NiO,FeO,Fe2O3,CoO,BaO和SiO2,最终要制备两种产物,一种是镍的氧化物,一种是CoCO3,所以FeO,![]() ,BaO和SiO2要在制备过程中逐步去除。第一步加酸溶解原料,考虑到发生的反应,就可得知滤渣和滤液的成分。题干中还提供了有关氢氧化物开始沉淀和沉淀完全的pH的表格,经过分析可知,要想去除铁元素,应当把铁元素全都转化为三价铁再调节pH才能在不降低产品产量的同时除净杂质铁元素。最后根据失重曲线判断物质的组成,可通过原子守恒进行计算,再进一步判断即可。
,BaO和SiO2要在制备过程中逐步去除。第一步加酸溶解原料,考虑到发生的反应,就可得知滤渣和滤液的成分。题干中还提供了有关氢氧化物开始沉淀和沉淀完全的pH的表格,经过分析可知,要想去除铁元素,应当把铁元素全都转化为三价铁再调节pH才能在不降低产品产量的同时除净杂质铁元素。最后根据失重曲线判断物质的组成,可通过原子守恒进行计算,再进一步判断即可。
【详解】(1)原料的成分有NiO,FeO,Fe2O3,CoO,BaO和SiO2;加入硫酸酸溶,SiO2不反应,所以会出现在滤渣中,BaO会最终变成BaSO4沉淀,所以也会出现在滤渣中;
(2)氧化步骤的目的是将二价铁转变成三价铁,便于在后续步骤中沉淀法除去,所以离子方程式为![]() ;
;
(3)加入Na2CO3这一步是为了除去铁,同时也要避免其他元素的损耗,所以选择的pH区间为3.7~7.2;
(4)萃取最关键的仪器是分液漏斗;加入碳酸氢钠后,产物之一是CoCO3沉淀,考虑到NaHCO3是过量的,所以最终的离子方程式为![]() ;
;
(5)由溶液获取结晶的常规操作是:蒸发浓缩,冷却结晶,过滤洗涤干燥;硫酸镍晶体的摩尔质量是263g/mol,所以26.3g即为0.1mol;280℃开始,固体的质量减少,这个时期是因为结晶水丢失导致的,所以A段对应的物质就是0.1mol的NiSO4;温度到600℃,固体的质量再次下降,得到最终的镍的氧化物;根据原子守恒,8.3g氧化物中Ni的质量为5.9g,那么O的质量为2.4g即0.15mol,所以固体氧化物中![]() ,所以固体氧化物即三氧化二镍。
,所以固体氧化物即三氧化二镍。
次氯酸溶液由于其具有极强的氧化性,可以使病毒的核酸物质发生氧化反应,从而杀灭病毒,是常用的消毒剂和漂白剂。已知:
Ⅰ.常温常压下,Cl2O ![]() 棕黄色气体,沸点为 3.8℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水立即反应生成 HClO。
棕黄色气体,沸点为 3.8℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水立即反应生成 HClO。
Ⅱ.将氯气和空气(不参与反应)按体积比1∶3 混合通入潮湿的碳酸钠中生成Cl2O 气体,用水吸收Cl2O(不含 Cl2)制得次氯酸溶液。某实验室利用以下装置制备浓度不小于 0.8mol/L 的次氯酸溶液。
A.  B.
B. 
C.  D.
D.  E.
E. 
回答下列问题:
(1)装置D 的作用为_______________。
(2)配平装置 B 中的反应___________:Cl2+Na2CO3+H2O = Cl2O+NaCl+NaHCO3。写出Cl2O 的结构式为_____。
(3)装置C 中加入的试剂X 为CCl4,其作用是__________。
(4)各装置的连接顺序为 A→____________→____________→______________→E。
(5)此方法相对于氯气直接溶于水制备次氯酸溶液的优点是__________。(答出 1 条即可)
(6)若装置 B 中生成的 Cl2O 气体有 20%滞留在E 前各装置中,其余均溶于装置E 的水中,装置E 所得 500mL 次氯酸溶液浓度为 0.8mol/L,则至少需要含水 8%的碳酸钠的质量为_____g。
(1). 除去氯气中的HCl气体;观察产生气泡的速度来调节流速和体积比 1:3 (2). 2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3 (3). Cl-O-Cl (4). 除去Cl2O 中的 Cl2,提高制得的 HClO 的纯度 (5). D (6). B (7). C (8). 制备的HClO的浓度大,纯度高,不含有Cl- (9). 57.6
【解析】
该实验属于物质制备类实验,所需原料为氯气和空气,并且要注意体积比1:3这个要求;因此就出现了这两个问题:(1)原料Cl2含有杂质需要除杂;(2)如何准确地控制两种原料气体积比;带着问题分析每个装置的作用就不难发现D装置就恰好能解决上述两个问题。接下来,由于B中的制备反应是气体与固体的反应,所以产物中肯定含有未反应完全的原料气,所以这里又出现了一个问题:未反应完的原料气是否会干扰后续的制备,如何除去;通过分析不难发现装置C恰好可以解决上述问题;最终在装置E中,成功制备了纯度较高的次氯酸溶液。
【详解】(1)装置D的作用一方面要对装置A制备的Cl2进行净化除杂,另一方面也要保证空气和氯气的最佳体积比;所以D的作用为:除去氯气中的HCl杂质,同时观察气泡的速度来调节氯气和空气的体积比至1:3;
(2)根据题意,B中发生的反应为2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,Cl2O中的O为-2价,Cl为+1价,所以该反应是氯元素的歧化反应;根据Cl2O中氯和氧的价态可推测其结构为Cl-O-Cl;
(3)题干中提到,用水吸收Cl2O制得次氯酸溶液,Cl2O中不能含有Cl2,而B处的反应是气体与固体的反应,必然会有一部分Cl2无法反应,因此,需要对B装置的出口气体进行除氯气操作,C中的CCl4由于与Cl2极性相近,可以将Cl2吸收,所以C的作用即:除去![]() 中的Cl2,提高次氯酸溶液的纯度;
中的Cl2,提高次氯酸溶液的纯度;
(4)结合以上分析,可知连接顺序为A→D→B→C→E;
(5)氯气直接溶解在水中会生成盐酸杂质,并且由于Cl2在水中溶解度很小,所以制备的次氯酸的浓度也不高,因此该方法的优点为:制备的次氯酸溶液浓度大,纯度高;
(6)由题可知,E中次氯酸的含量为0.4mol,根据E中发生的反应:![]() ,可知E中参与反应的n(Cl2O)=0.2mol,所以总共生成的Cl2O的物质的量为
,可知E中参与反应的n(Cl2O)=0.2mol,所以总共生成的Cl2O的物质的量为![]() 。根据Cl2O的制备反应方程式可知,所需碳酸钠的物质的量为:
。根据Cl2O的制备反应方程式可知,所需碳酸钠的物质的量为:![]() ,那么至少需要含水量8%的碳酸钠的质量为
,那么至少需要含水量8%的碳酸钠的质量为![]() 。
。
【点睛】在考虑制备类实验的装置连接顺序时,可先找出其中的原料发生装置,反应制备装置和尾气处理装置,再根据具体信息考虑这些装置之间的除杂干燥防倒吸问题,最终设计出合理的连接顺序。
本卷还有7题,登录并加入会员即可免费使用哦~

该作品由: 用户王立颖分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。