铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
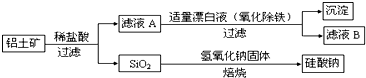
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
(1). 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ (2). 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分) (3). c (4). 冷却结晶 (5). Al3++3H2O ![]() Al(OH)3(胶体)+3H+ (6). 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
Al(OH)3(胶体)+3H+ (6). 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
【解析】
(1). ①滤液A中含有氯化铁和氯化亚铁、氯化铝,加入漂白液,目的是氧化除铁,所得滤液B显酸性,说明生成了氢离子,次氯酸根离子具有氧化性氧化亚铁离子生成铁离子,在溶液中形成氢氧化铁沉淀除去,次氯酸根离子被还原为氯离子,根据电子守恒和电荷守恒分析,所以反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,故答案为 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ ; ②滤液B中是否含有铁元素的方法为利用铁离子的检验方法进行,铁离子遇到硫氰化钾显红色,所以答案为: 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分);③ 滤液B 中铝元素以铝离子形式存在,将其转化为沉淀需要加入氨水,加入氢氧化钠不好控制其物质的量多少,因为氢氧化铝可以溶于氢氧化钠,故答案为c; ④滤液B制备氯化铝晶体涉及的的方法为重结晶,将溶液加热浓缩,然后冷却结晶,过滤、洗涤、干燥即可得氯化铝晶体,故答案为冷却结晶;Ⅱ、 (1) 明矾净水是明矾中的铝离子水解生成氢氧化铝胶体具有吸附作用,故答案为Al3++3H2O ![]() Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。
Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。
点睛:常用的离子检验的方法有:
颜色:铜离子为蓝色、铁离子为浅黄色、亚铁离子为浅绿色,高锰酸根离子为紫色。
硫酸根离子:加入盐酸酸化,再加入氯化钡溶液,产生白色沉淀。
氯离子:加入稀硝酸酸化,再加入硝酸银溶液,产生白色沉淀。
碳酸根离子:加入氯化钙,产生白色沉淀,沉淀溶于盐酸产生无色无味的能使澄清的石灰水变浑浊的气体。
铝离子:加入氢氧化钠溶液,先产生沉淀后沉淀溶解。
铁离子:加入氢氧化钠溶液,生成红褐色沉淀,或加入硫氰化钾溶液,显红色,或加入苯酚,显紫色。
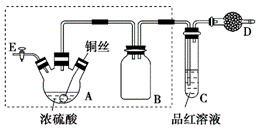
某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________。
(2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。
(3)装置A中发生反应的化学方程式为____________________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
(1). 关闭旋塞E,装置C中加水没过导管口,给A装置微热,装置C中导管口有气泡冒出,撤去热源后,导管内有倒吸产生的液柱,且高度保持不变 (2). 三颈烧瓶; (3). 防倒吸 (4). 碱石灰 (5). Cu+2H2SO4═CuSO4+SO2↑+2H2O (6). 打开旋塞E,从E管口向A中鼓入大量空气 (7). 混合时放热,白色固体溶解,溶液变蓝色 (8). 水加入浓硫酸中,放出大量热使液体飞溅
【解析】
(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)仪器A的名称是三颈烧瓶,仪器B的作用是防止二氧化硫倒吸,仪器D是处理尾气,而二氧化硫是酸性气体,所以D中所盛药品是碱石灰或NaOH固体;
(3)铜与浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水;
(4)从E处鼓入空气或氮气,使体系中的二氧化硫完全除净;
(5)硫酸铜晶体溶于水溶液变蓝色;铜元素的焰色反应呈黄绿色,水加入浓硫酸中,放出大量热使液体飞溅.
【详解】(1)对于简易装置的气密性检查时,一般对瓶内气体加热,然后看有无气泡冒出或冷却后看导管口是否形成一段水柱,所以要关闭旋塞E,装置C中加水没过导管口,给A装置微热,装置C中导管口有气泡冒出,撤去热源后,导管内有倒吸产生的液柱,且高度保持不变;
故答案为关闭旋塞E,装置C中加水没过导管口,给A装置微热,装置C中导管口有气泡冒出,撤去热源后,导管内有倒吸产生的液柱,且高度保持不变;
(2)仪器A的名称是三颈烧瓶,仪器B的作用是防止二氧化硫倒吸,仪器D是尾气处理,而二氧化硫是酸性气体,所以D中所盛药品是碱石灰或NaOH固体;
故答案为三颈烧瓶;防倒吸;碱石灰;
(3)铜与浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4═CuSO4+SO2↑+2H2O;
故答案为Cu+2H2SO4═CuSO4+SO2↑+2H2O;
(4)从E处鼓入空气或氮气,使体系中的二氧化硫完全除净,所以操作为:打开旋塞E,从E管口向A中鼓入大量空气,故答案为打开旋塞E,从E管口向A中鼓入大量空气;
(5)硫酸铜晶体溶于水溶液变蓝色;水加入浓硫酸中,放出大量热使液体飞溅;
故答案为混合时放热,白色固体溶解,溶液变蓝色;水加入浓硫酸中,放出大量热使液体飞溅。
海带中碘含量比较高,从海带提取碘的操作如下:
(1)将干海带进行灼烧的仪器是____________,海带灰中含有较多KI,将海带灰溶于水,然后过滤得到澄清滤液。
(2)向上述滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。请写出离子反应方程式:___________________________________________________________。
(3)向上述碘的水溶液中加入适量CCl4,振荡,静置,则I2会转入到CCl4层中,这个过程叫_____________________,现象为________________________________________。
(4)3I2+6KOH=5KI+KIO3+3H2O,1.5mol I2完全反应转移电子的物质的量为_____mol,氧化剂与还原剂的物质的量之比为___________。
(5)某一反应体系有反应物和生成物共6种物质:O2、K2Cr2O7、Cr2(SO4)3、H2SO4、H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,氧化剂为_______________;氧化产物为_______________。
②写出该反应的化学方程式______________________________________________。
(1). 坩埚 (2). H2O2+2I-+2H+=2H2O+I2 (3). 萃取 (4). 溶液分两层,上层为无色,下层为紫红色; (5). 2.5mol (6). 5:1 (7). K2Cr2O7 (8). O2 (9). K2Cr2O7+2H2O2+4H2SO4=Cr2(SO4)3+7H2O+3O2↑+K2SO4
【解析】(1)灼烧在坩埚中进行,故答案为:坩埚;
(2)H2O2将I-氧化成I2,H2O2被还原成H2O,反应的离子方程式为:H2O2+2I-+2H+=2H2O+I2,故答案为:H2O2+2I-+2H+=2H2O+I2;
(3)用CCl4将碘从碘的水溶液中提取出来,该操作叫萃取,静置后溶液分层,CCl4的密度比水大,所以I2的CCl4在下层,下层为紫红色,上层为水层,无色,故答案为:萃取;溶液分两层,上层为无色,下层为紫红色;
(4)I元素化合价由0价升高到+5价,也从0价降低到-1价,结合电子得失守恒可知,每3molI2参与反应,有5molI原子化合价降低,被还原,有1molI原子化合价升高,被氧化,转移电子的物质的量为5mol,则1.5mol I2完全反应转移电子的物质的量为2.5mol,氧化剂与还原剂的物质的量之比=5:1,故答案为:2.5mol;5:1;
(5)H2O2→O2,O元素化合价升高,则K2Cr2O7→Cr2(SO4)3,由K原子、S原子守恒可知:H2SO4→K2SO4,由H原子守恒可知,H2O为生成物,故反应的方程式为:K2Cr2O7+2H2O2+4H2SO4=Cr2(SO4)3+7H2O+3O2↑+K2SO4。
①K2Cr2O7中Cr元素的化合价降低,作氧化剂,H2O2→O2,O元素化合价升高,H2O2被氧化,得氧化产物,所以O2为氧化产物,故答案为:K2Cr2O7;O2;
②由上面可知,化学反应方程式为K2Cr2O7+2H2O2+4H2SO4=Cr2(SO4)3+7H2O+3O2↑+K2SO4,故答案为:K2Cr2O7+2H2O2+4H2SO4=Cr2(SO4)3+7H2O+3O2↑+K2SO4。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
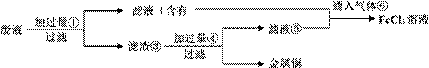
请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
(1). KSCN (2). 溶液变成血红色 (3). 2Fe3++Cu![]() 2Fe2++Cu2+ (4). Fe (5). HCl (6). C (7). 2Fe2++Cl2
2Fe2++Cu2+ (4). Fe (5). HCl (6). C (7). 2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
【解析】
(1)本题考查Fe3+检验,检验Fe3+常用KSCN溶液,如果溶液变为血红色,说明含有Fe3+,反之不含有;(2)本题考查Cu和Fe3+反应,离子反应方程式为Cu+2Fe3+=2Fe2++Cu2+;(3)本题考查化学工艺流程,本实验目的是回收铜和制取纯净的FeCl3,向废液中加入过量的铁屑,然后过滤,滤液为FeCl2,滤渣为Cu和Fe,因为铁能与盐酸反应,铜和盐酸不反应,因此滤渣③中加入过量的盐酸,过滤,得到金属铜,两种滤液合并,通入氯气,把Fe2+氧化成Fe3+;(4)本题考查离子检验,检验某溶液中不含Fe3+,含Fe2+,应先加KSCN溶液,溶液不变红,说明不含Fe3+,再加入氧化剂,溶液变红,说明原溶液中含Fe2+,不含Fe3+,氧化剂不能是酸性高锰酸钾溶液,因为高锰酸钾溶液能氧化KSCN,故选项C正确;(5)本题考查离子反应方程式的书写,⑥为氯气,发生的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-。
向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A. 0. 24 mol B. 0. 21 mol C. 0. 16 mol D. 0. 14 mol
B
【解析】NO的物质的量为![]() =0.06mol,所得溶液中加入KSCN,不出现红色,说明溶液中只有Fe2+没有Fe3+,即只为Fe(NO3)2,根据氮原子守恒分析,Fe(NO3)2中的硝酸根离子的物质的量为4×0.12-0.06=0.42mol,则Fe2+的物质的量为0.21mol,若用足量的CO还原质量相同的混合物,则铁元素全以铁单质的形式出来,则铁的物质的量为0.21mol,B选项正确;
=0.06mol,所得溶液中加入KSCN,不出现红色,说明溶液中只有Fe2+没有Fe3+,即只为Fe(NO3)2,根据氮原子守恒分析,Fe(NO3)2中的硝酸根离子的物质的量为4×0.12-0.06=0.42mol,则Fe2+的物质的量为0.21mol,若用足量的CO还原质量相同的混合物,则铁元素全以铁单质的形式出来,则铁的物质的量为0.21mol,B选项正确;
答案选B。
【点睛】掌握守恒法在本题中的应用,氮元素的守恒,硝酸的物质的量=NO的物质的量+ Fe(NO3)2的物质的量×2,Fe(NO3)2的物质的量=CO还原后的铁的物质的量。
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户宝宝分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。