离子键、共价键、金属键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是
A. 干冰 B. NaCl C. NaOH D. H2SO4
B
【解析】A. 干冰是由二氧化碳分子构成的分子晶体,分子内存在极性共价键,分子间存在分子间作用力,故A错误;
B. 氯化钠晶体是离子晶体,在晶体中只存在离子键,故B正确;
C. 氢氧化钠固体是离子晶体,在晶体中存在离子键和极性共价键,故C错误;
D. 硫酸是由分子构成的分子晶体,分子内存在极性共价键,分子间存在分子间作用力,故D错误;
故选B。
在第二周期元素中,第一电离能介于B、N之间的元素种类数为( )
A. 1 B. 2 C. 3 D. 4
C
【解析】同周期自左向右电离能逐渐增大,但由于Be元素的2s轨道电子处于全充满状态,稳定性强,因此Be元素的第一电离能大于B元素的第一电离能,氮元素的2p轨道电子处于半充满状态,稳定性强,因此氧元素第一电离能小于氮元素的第一电离能,因此第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,故选C。
【点睛】因N的最外层轨道电子数处于半充 满的稳定状态,因此N的第一电离能反常大于O,Be的价层电子排布处于全满的稳定结构,其第 一电离能大于B是解答关键。
将氯化钠加热至熔融状态后进行电解,可得到金属钠与氯气,此过程中
A. 破坏了金属键 B. 破坏了共价键
C. 形成了离子键 D. 形成了共价键
D
【解析】将氯化钠加热至熔融状态形成钠离子和氯离子,破坏了氯离子和钠离子之间的离子键,得到金属单质,故形式金属键,生成氯气,氯气中氯原子之间为共价键,即形成共价键,故答案为D。
价电子排布为5s25p1的元素,在周期表中的位置是
A. 第四周期第ⅤA族 B. 第五周期第ⅢA族
C. 第五周期第ⅠA族 D. 第四周期第ⅢA族
B
【解析】根据题中所给的信息,结合已经学习过的知识分析,电子层数=周期数,价电子数=主族元素的族序数,所以该元素位于第五周期第ⅢA族,答案选B。
氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A. 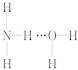 B.
B. 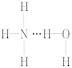 C.
C. 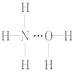 D.
D. 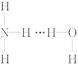
B
【解析】从氢键的成键原理上讲,A、B两项都成立;但从立体构型上讲,由于氨分子是三角锥形,N原子易提供孤电子对,所以,以选项B的方式结合成氢键时,空间阻碍最小,结构最稳定;从事实上讲,依据NH3·H2O![]() N+OH-,可知答案是选项B。
N+OH-,可知答案是选项B。
本卷还有24题,登录并加入会员即可免费使用哦~

该作品由: 用户8621479分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。