已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
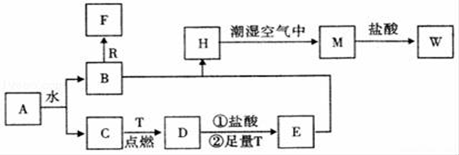
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
(1). Na2O2 (2). Fe3O4 (3). FeCl3 (4). 2Al+2OH﹣+2H2O=2AlO﹣2+3H2↑ (5). 2Na2O2+2CO2=2Na2CO3+O2 (6). 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3;
【详解】A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,Fe3O4与盐酸反应生成FeCl2和FeCl3,加入过量的Fe,Fe与FeCl3反应生成FeCl2,即E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3,
(1)根据上述分析,物质A为Na2O2,D的化学式为Fe3O4,W的化学式为FeCl3;
(2)Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Na2O2与CO2反应![]() 方程式为2Na2O2+2CO2=2Na2CO3+O2;
方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)Fe(OH)2被氧气氧化成Fe(OH)3,其反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=___________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+= Fe2++ Cu、____________、____________。
② 试剂B是__________。
③ 操作③是蒸发浓缩、冷却结晶、___________,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是____________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是________mol。
(1). 0.01 (2). Fe +2Fe3+=3Fe2+ (3). Fe +2H+=Fe2++H2↑ (4). 硫酸 (5). 过滤 (6). 取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽 (7). FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水) (8). 12
【解析】(1)根据电荷守恒知,c(H+)+3 c(Fe3+)+2 c(Cu2+)+ c(Na+)= c(OH-)+2 c(SO42-),废水呈强酸性,氢氧根浓度很小,计算时可忽略,代入题给数据计算得c(H+)=0.01 mol/L;
(2)① 工业废水中含有硫酸铜、硫酸铁和硫酸,加入铁粉后,反应的离子方程式为:Fe + Cu2+=Fe2++ Cu、Fe +2Fe3+=3Fe2+、Fe +2H+= Fe2++H2↑。② 过滤,固体C为铁和铜的混合物,加入过量硫酸,过滤,得铜和硫酸亚铁溶液,故试剂B是硫酸。③ 操作③是从溶液中获得晶体的操作,为蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥。④Fe3+的检验用KSCN溶液,故判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽。⑤ Fe2+易被氧化,绿矾晶体易失去结晶水,故FeSO4·7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水)。⑥ 1000 L废水中n(Fe3+)=2mol,560g铁粉的物质的量为10mol,根据铁元素守恒知,经上述处理,可获得 FeSO4·7H2O的物质的量是12mol。
工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
(1). 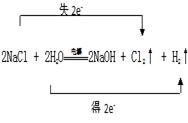 (2). 2Cl—+2H2O
(2). 2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑ (3). Cl2 (4). H+ +OH—=H2O (5). CO3 2- + 2H+ =H2O+ CO2↑ (6). 2.0 (7). ②①③⑧⑤⑥⑦④ (8). A
2OH—+Cl2↑+H2↑ (3). Cl2 (4). H+ +OH—=H2O (5). CO3 2- + 2H+ =H2O+ CO2↑ (6). 2.0 (7). ②①③⑧⑤⑥⑦④ (8). A
【解析】
(1)反应中氯化钠中氯元素的化合价升高生成氯气,氯化钠做还原剂,水中氢元素化合价降低生成氢气,水做氧化剂,反应中转移电子数目为2e—;
(2)反应中Cl元素化合价升高的被氧化,氯气为氧化产物;
(3)在滤液中加入盐酸,目的是除去溶液中过量的氢离子和碳酸根离子;
(4)根据n=cM计算出氢氧化钠的物质的量;根据配制一定物质的量浓度的溶液的配制步骤进行排序;分析操作对溶质的物质的量或对溶液的体积的影响,根据c=n/V判断。
【详解】(1)电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,反应中氯化钠中氯元素的化合价升高生成氯气,氯化钠失电子做还原剂,水中氢元素化合价降低生成氢气,水得电子做氧化剂,反应中转移电子数目为2e—,双线桥为: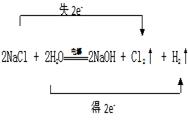 ;离子方程式为:2Cl—+2H2O
;离子方程式为:2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑,故答案为
2OH—+Cl2↑+H2↑,故答案为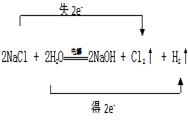 ;2Cl—+2H2O
;2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑;
2OH—+Cl2↑+H2↑;
(2)反应中Cl元素化合价升高的被氧化,氯化钠失电子做还原剂,氯气为氧化产物,故答案为Cl2;
(3)精制时依次加入氯化钡溶液、纯碱、烧碱,氯化钡溶液除去硫酸根离子,纯碱除去钡离子、钙离子,烧碱除去镁离子;充分反应后过滤,在滤液中加入盐酸,目的是除去溶液中过量的氢离子和碳酸根离子,则在滤液中加入盐酸中和至中性的离子方程式为:H++OH-=H2O,CO3 2- + 2H+ =H2O+ CO2↑,故答案为H++OH-=H2O;CO3 2- + 2H+ =H2O+ CO2↑;
(4)实验室配制90ml 0.5 mol/L的NaOH溶液应选用100ml容量瓶,需氢氧化钠的质量为m=0.5L×0.1mol•L-1×40g/mol=2.0g,故答案为2.0g;
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,实验先后顺序为②①③⑧⑤⑥⑦④,故答案为②①③⑧⑤⑥⑦④;
A、有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低;
B、液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,冷却后会导致溶液体积偏小,溶液浓度偏高;
C、容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
故答案为A。
(1)现有物质:①NaCl晶体 ②CO2 ③氨水 ④蔗糖 ⑤BaSO4固体 ⑥铜 ⑦熔融的KNO3
试回答(填序号):能导电的是_____________;属于电解质的是____________。
(2)一定量的金属铝跟足量NaOH溶液反应,放出3.36LH2(标准状况下),则该铝的质量是______g,如反应后溶液的体积为500mL,则反应后溶液中NaAlO2的物质的量浓度为_______mol/L。
(3)同温同压下的两个相同容器中分别装有NO和NO2气体,则两瓶气体中,质量之比是________,分子数之比是________。
(4)设NA表示阿伏加德罗常数,如果x g某气体含有的分子数是y,则z g该气体在标准状况下的体积是_______L(用含NA的式子表示)。
(1). ③⑥⑦ (2). ①⑤⑦ (3). 2.7 (4). 0.2 (5). 15:23 (6). 1:1 (7). 22.4yz/(xNA)
【解析】
(1)存在自由移动的带电微粒即可导电;在水溶液中或熔化状态下能导电的化合物属于电解质,在水溶液中和熔化状态下都不能导电的化合物属于非电解质;
(2)Al与足量的NaOH溶液反应生成氢气,根据方程式计算Al的物质的量,再计算铝的质量和NaAlO2的物质的量浓度;
(3)同温同压下气体的气体摩尔体积相等,根据n=V/Vm=m/M=N/NA结合分子组成计算;
(4)a g某气体中含有的分子数为b,据此可以设计成cg该气体中含有的分子数,然后根据n=N/NA计算出cg该气体的物质的量,再根据V=nVm计算出标况下cg该气体的体积。
【详解】(1)氨水中存在自由移动的离子能导电;铜中存在自由移动的电子则能导电;熔融的KNO3中存在自由移动的离子能导电;NaCl、BaSO4、KNO3都是化合物,且在水溶液中或熔化状态下能导电,则属于电解质,故答案为③⑥⑦;①⑤⑦;
(2)合金溶于足量的NaOH溶液中,铝和氢氧化钠反应:2Al+2NaOH+2H2O=2NaAlO2
+3H2↑,产生气体氢气3.36L(标准状况),其物质的量= 3.36L/22.4L/mol =0.15mol,由方程式可知n(Al)= 2 n(H2)/3 =0.15mol× 2/3 =0.1mol,则m(Al)= 0.1mol×27g/mol;由铝原子个数守恒可知,n(NaAlO2)= n(Al)=0.1mol,c(NaAlO2)= n(NaAlO2)/V=0.1mol/0.5L=0.2 mol/L,故答案为2.7;0.2;
(3)同温同压下的两个相同容器中分别装有NO和NO2气体,由于同温同压下气体的气体摩尔体积相等,由n=V/Vm可知,气体的分子数相等,分子数比值为1:1,质量比等于摩尔质量之比,为15:23,故答案为1:1;15:23;
(4)如果xg某气体中含有的分子数为y,则zg该气体含有的分子数为:y×zg/xg=yz/x,含有的气体的物质的量为n=yz/xNAmol,则c g该气体在标准状况下的体积为:V=22.4L/mol×yz/xNAmol=22.4yz/xNA,故答案为22.4yz/xNA。
【点睛】本题考查了物质的分类和常用化学计量有关计算,比较基础,涉及物质的量、微粒个数、气体体积、物质的量浓度的计算,解答时注意对公式的理解与灵活应用。
有下列四组混合物,如何进行分离?请将分离的方法填在横线上。
(1)水和酒精。___
(2)碘和四氯化碳。___
(3)水和四氯化碳。___
(4)硝酸钠溶液中的氯化银。___
(5)硝酸钾和氯化钠。___
(1). 蒸馏法 (2). 蒸馏法 (3). 分液法 (4). 过滤法 (5). 重结晶
【解析】
(1)分离互溶的液体用蒸馏的方法;
(2)分离互溶的液体用蒸馏的方法;
(3)水和四氯化碳不互溶,分层;
(4)氯化银难溶于水,硝酸钠易溶于水;
(5)硝酸钾和氯化钠的溶解度随温度的升高变化规律不同。
【详解】(1)水和酒精互溶,用蒸馏法分离;
(2)碘和四氯化碳互溶,用蒸馏法分离;
(3)水和四氯化碳不互溶,分层,直接用分液的方法进行分离;
(4)硝酸钠易溶于水,氯化银难溶于水,将混合物溶解,过滤即可分离;
(5)硝酸钾的溶解度随温度的升高逐渐降低,氯化钠的溶解度随温度的升高逐渐增大,因此用重结晶的方法可将其分离。
本卷还有25题,登录并加入会员即可免费使用哦~

该作品由: 用户宁馨儿分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。