有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
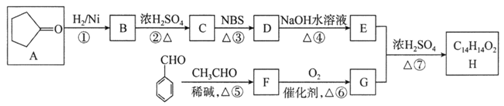
已知:信息① CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
信息② ![]()
回答下列问题:
(1)C的化学名称为________________,D中的官能团名称是__________________。
(2)②的反应类型是______________________________________。
(3)F的结构简式为______________________________________。
(4)写出由E和G生成H的化学方程式:__________________________________________。
(5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。
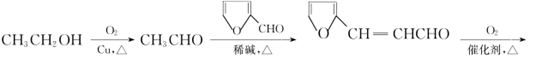
(6)呋喃丙烯酸(![]() )是一种医治血吸虫病的药物
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以![]() 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
(1). 环戊烯 (2). 溴原子、碳碳双键 (3). 消去反应 (4). ![]() (5).
(5). ![]() (6). 6 (7).
(6). 6 (7). ![]() (8).
(8). 
![]()
【解析】
A为![]() ,与H2发生加成反应生成的B应为
,与H2发生加成反应生成的B应为![]() ,
,![]() 再在浓硫酸的催化作用下发生消去反应生成C,C为
再在浓硫酸的催化作用下发生消去反应生成C,C为![]() ,C反应信息①的反应生成D为
,C反应信息①的反应生成D为![]() ,D发生水解反应生成E为
,D发生水解反应生成E为![]() ;
; ![]() 与CH3CHO发生信息②的反应生成的F为
与CH3CHO发生信息②的反应生成的F为![]() ,
,![]() 被氧化生成G,G和E能发生酯化反应,则G为
被氧化生成G,G和E能发生酯化反应,则G为![]() ,H为
,H为![]() ;据此解答。
;据此解答。
【详解】(1)C为![]() ,其化学名称为环戊烯,D为
,其化学名称为环戊烯,D为![]() ,含有的官能团名称是溴原子和碳碳双键;
,含有的官能团名称是溴原子和碳碳双键;
(2)反应②为![]() 在浓硫酸的催化作用下发生消去反应生成C,则反应类型是消去反应;
在浓硫酸的催化作用下发生消去反应生成C,则反应类型是消去反应;
(3)由分析知F的结构简式为![]() ;
;
(4)G和E能发生酯化反应生成H的化学方程式为![]() ;
;
(5)H为![]() ,化合物H的同分异构体Q为芳香族化合物,说明含有苯环;H、Q分别与足量H2进行催化加成,能生成同一产物,则:①如果五元环上不含碳碳双键,则支链中含有C≡C键,有1种;②如果五元环上有2个碳碳双键,且两个碳碳双键不能相邻,有3种;③如果五元环上有1个C≡C键,有2种,则符合条件的有6种;其中分子内存在碳碳叁键的同分异构体的结构简式为
,化合物H的同分异构体Q为芳香族化合物,说明含有苯环;H、Q分别与足量H2进行催化加成,能生成同一产物,则:①如果五元环上不含碳碳双键,则支链中含有C≡C键,有1种;②如果五元环上有2个碳碳双键,且两个碳碳双键不能相邻,有3种;③如果五元环上有1个C≡C键,有2种,则符合条件的有6种;其中分子内存在碳碳叁键的同分异构体的结构简式为![]() ;
;
(6)乙醇被催化氧化生成乙醛,乙醛和![]() 反应生成
反应生成![]() ,然后催化氧化得到
,然后催化氧化得到![]() ,其合成路线为
,其合成路线为
![]() 。
。
二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
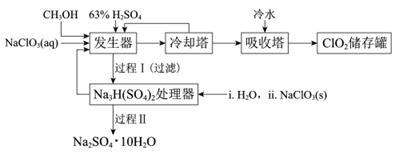
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
| 物质 | CH3OH | HCOOH | ClO2 |
| 熔点/℃ | -97 | 9 | -59 |
| 沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
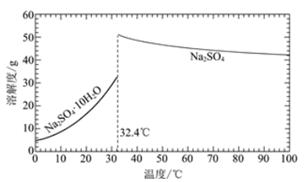
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
(1). 氧化 (2). B (3). ![]() ,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出 (4). 冷却结晶,过滤,洗涤,干燥 (5). H2SO4
,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出 (4). 冷却结晶,过滤,洗涤,干燥 (5). H2SO4
【解析】
由流程可知,发生器中制备ClO2, 冷却塔用于分离ClO2并回收CH3OH,在吸收塔中用冷水冷凝ClO2,最后再储存;发生器中生成的Na3H(SO4)2进入Na3H(SO4)2处理器,用H2O2和NaClO3处理得到Na2SO4·10H2O。
【详解】(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有氧化性,故答案为:氧化;
(2)冷却塔用于分离ClO2并回收CH3OH,根据表格中相关物质的溶解度,控制的温度应该使CH3OH液化,但是ClO2不能液化,只有B项合适,答案选B;
(3)①在处理器中会发生反应:![]() ,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出,故答案为:
,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出,故答案为:![]() ,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出;
,加入NaClO3,使钠离子浓度增大,平衡逆向移动,有利于Na2SO4·10H2O的析出;
②过程Ⅱ的操作为在32.4℃恒温蒸发后,再冷却结晶,过滤,洗涤,干燥,故答案为:冷却结晶,过滤,洗涤,干燥;
③Na3H(SO4)2处理器的滤液中可以循环利用的原料为NaClO3和H2SO4,故答案为:H2SO4。
氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
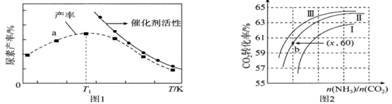
①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2![]() 转化率与氨碳比
转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
(1). -87.0 (2). 不是 (3). 升高温度反应逆向移动;催化剂活性降低 (4). Ⅰ (5). 4 (6). ![]() (7). 14-b<pH<14-a (8). N2H6(HSO4)2
(7). 14-b<pH<14-a (8). N2H6(HSO4)2
【解析】(1)已知:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+440 kJ·mol-1
NH3与CO2合成尿素同时生成液态水的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l),根据盖斯定律I+II-III得2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l),则△H=-159.5kJ•mol-1+(+116.5kJ•mol-1)-(+44.0kJ•mol-1)=-87.0 kJ•mol-1;
(2)①产率最高之前,未达到平衡状态,反应为放热反应,达到平衡之后,升高温度,平衡逆向移动,产率下降,且催化剂活性降低;
②氨碳比相同时曲线Ⅲ二氧化碳的转化率大,所以曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是为Ⅰ;由题意可知:
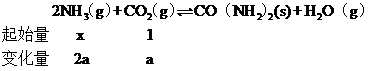
即![]() ,
,![]() =0.6,则x=4;
=0.6,则x=4;
③当V正=V逆时反应达到平衡,即![]() ,此时平衡常数K=
,此时平衡常数K=![]() =
=![]() ;
;
(3)①N2H4+H2O⇌N2H5++OH- K1=1×10-a;N2H5++H2O⇌N2H62++OH- K2=1×10-b,可知K1= 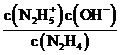 =1×10-a,K2=
=1×10-a,K2= 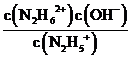 =1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14-a;
=1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14-a;
②既然水合肼的性质类似一水合氨,在水中应该能电离产生N2H62+和OH-,因此它的硫酸酸式盐的化学式为(N2H6)(HSO4)2。
【点睛】通常应用盖斯定律进行简单计算的基本方法是参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”。已知它易溶于水,难溶于乙醇,在中性或碱性环境中稳定,受热、遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
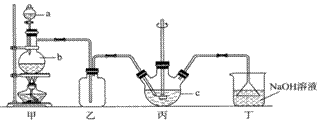
(1)装置甲中,a仪器的名称是____________;a中盛有浓硫酸,b中盛有亚硫酸钠,实验中要控制SO2生成速率,可以采取的措施有_________________________(写出一条即可)。
(2)装置乙的作用是____________________________________。
(3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为:________________________________________。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为_________。(实验中供选用的试剂及仪器:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管.提示:室温时CaCO3饱和溶液的pH=9.5)
(5)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用_____________洗涤。为了测定粗产品中Na2S2O3·5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应)。称取1.50g粗产品溶于水,用0.20 mol·L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中![]() 全部被氧化为
全部被氧化为![]() 时,消耗高锰酸钾溶液体积40.00mL。
时,消耗高锰酸钾溶液体积40.00mL。
①写出反应的离子方程式:________________________________________。
②产品中Na2S2O3·5H2O的质量分数为____________________(保留小数点后一位)。
(1). 分液漏斗 (2). 控制反应温度、控制滴加硫酸的速度 (3). 安全瓶,防倒吸 (4). 4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2 (5). 取少量样品于试管(烧杯)中,加水溶解,加入过量的CaCl2溶液,振荡(搅拌),静置,用pH计测定上层清液的pH,若pH大于9.5,则含有NaOH (6). 乙醇 (7). ![]() (8). 82.7%
(8). 82.7%
【解析】
装置甲为二氧化硫的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,丙装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,因SO2易溶于碱性溶液,为防止产生倒吸,在甲、丙之间增加了乙装置;另外二氧化硫有毒,不能直接排放到空气中,装置丁作用为尾气吸收装置,吸收未反应的二氧化硫。据此解答。
【详解】(1)装置甲中,a仪器的名称是分液漏斗;利用分液漏斗控制滴加硫酸的速度、控制反应温度等措施均能有效控制SO2生成速率;
(2)SO2易溶于碱性溶液,则装置乙的作用是安全瓶,防倒吸;
(3)Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,即生成Na2S2O3和CO2,结合原子守恒即可得到发生反应的化学方程式为4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
(4)碳酸钠溶液和NaOH溶液均呈碱性,不能直接测溶液的pH或滴加酚酞,需要先排除Na2CO3的干扰,可取少量样品于试管(烧杯)中,加水溶解,加入过量的CaCl2溶液,振荡(搅拌),静置,用pH计测定上层清液的pH,若pH大于9.5,则含有NaOH;
(5)硫代硫酸钠易溶于水,难溶于乙醇,在中性或碱性环境中稳定,则硫代硫酸钠粗品可用乙醇洗涤;
①Na2S2O3溶液中滴加酸性KMnO4溶液,溶液紫色褪去,溶液中![]() 全部被氧化为
全部被氧化为![]() ,同时有Mn2+生成,结合电子守恒和原子守恒可知发生反应的离子方程式为5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O;
,同时有Mn2+生成,结合电子守恒和原子守恒可知发生反应的离子方程式为5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O;
②由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.04L×0.2mol/L=0.005mol,则m(Na2S2O3•5H2O)=0.005mol×248g/mol=1.24g,则Na2S2O3•5H2O在产品中的质量分数为
×0.04L×0.2mol/L=0.005mol,则m(Na2S2O3•5H2O)=0.005mol×248g/mol=1.24g,则Na2S2O3•5H2O在产品中的质量分数为![]() ×100%=82.7%。
×100%=82.7%。
【点睛】考查硫代硫酸钠晶体制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用、二氧化硫的性质的探究,侧重于学生的分析能力、实验能力的考查,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的探究。
铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________;
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________的杂化方式。
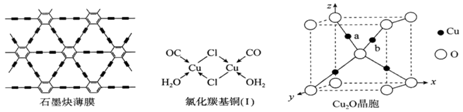
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________σ键数目。
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________(填“高”或“低”),请解释原因___________________。
(1). 14 (2). 大于 (3). Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- (4). sp、sp2 (5). 14 (6). 4 (7). (0.75,0.75,0.75) (8). 高 (9). 两者都是离子晶体,O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
【解析】(1)Cu为29号元素,根据构造原理知其基态电子排布为1s22s22p63s23p63d104s1,则基态铜原子核外有14对自旋相反![]() 电子;
电子;
(2)金属性越强,越易失电子,第一电离能越小,Sn和Pb为同主族元素,且金属性Sn小于Pb,则第一电离能I1(Sn)大于I1(Pb);
(3)新制的Cu(OH)2能够溶解于浓氨水中,生成可溶于水的[Cu(NH3)4]2+,则反应的离子方程式是Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(4)碳碳三键中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;苯环中的碳形成3个δ键,无孤电子对,采取sp2杂化;
(5)在氯化羰基亚铜(I)中C和O之间有1个σ键,H2O分子内有2个σ键,配位键也是σ键,则氯化羰基亚铜(I)中含14个σ键;
(6)①Cu2O晶胞中,O原子周围最靠近的Cu原子数目是4,则O原子的配位数为4;a位置为顶点O原子和中心O原子的![]() 处,且顶点O原子与a之间的距离为对角线的
处,且顶点O原子与a之间的距离为对角线的![]() ,已知a位置Cu+坐标为(0.25,0.25,0.75),即晶胞边长为1,则b位置Cu+坐标为(0.75,0.75,0.75);
,已知a位置Cu+坐标为(0.25,0.25,0.75),即晶胞边长为1,则b位置Cu+坐标为(0.75,0.75,0.75);
②Cu2S与Cu2O都是离子晶体,O2-半径比S2-半径小,所以Cu2O的晶格能更大,则Cu2O熔点更高。
本卷还有15题,登录并加入会员即可免费使用哦~

该作品由: 用户黄飞分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。