下图为几种晶体或晶胞的示意图:
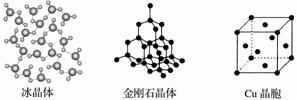
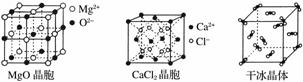
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体,原因是________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
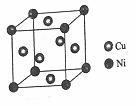
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________________________。
(1)金刚石晶体
(2)金刚石>MgO>CaCl2>冰>干冰
(3)小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)
(4)4 8
(5)水分子之间形成氢健
解析:(2)离子晶体的熔点与离子半径及离子所带电荷数有关,离子半径越小,离子所带电荷数越大,则离子晶体熔点越高。金刚石是原子晶体,熔点最高,冰、干冰均为分子晶体,冰中存在氢键,冰的熔点高于干冰。
(4)铜晶胞实际占有铜原子数用均摊法分析,8×+6×=4,氯化钙类似于氟化钙,Ca2+的配位数为8,Cl-配位数为4。
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
请回答下列问题:
(1)上述化学方程式中涉及的N、O、P元素的电负性由小到大的顺序是____________。
(2)基态S原子的价电子排布式为____________。
(3)(NH4)2SO4中含有化学键的类型为_________________________________________。
(4)PO43-的立体构型是__________,其中P原子的杂化方式为________。
(5)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键数目为______,1 mol [Cu(CN)4]2-中含有的σ键数目为________。
(1)P<N<O
(2)3s23p4
(3)离子键、共价键
(4)正四面体 sp3
(5)2NA 8NA
解析: (1)同周期主族元素的电负性从左到右逐渐增大,则有电负性:N<O;同主族元素的电负性自上而下逐渐减弱,则有电负性:N>P。
(2)基态S原子核外有16个电子,根据核外电子排布规律,其价电子排布式为3s23p4。
(3)(NH4)2SO4分子中存在N—H极性共价键和S—O极性共价键,NH4+和SO42-之间存在离子键。
(4)PO43-中P原子的价层电子对数为4+=4,则P原子采取sp3杂化,故PO43-的立体构型为正四面体。
(5)CN-中C、N原子之间存在C≡N键,1个CN-中存在1个σ键、2个π键,故1 mol CN-含有2 mol π键。[Cu(CN)4]2-中Cu2+为中心离子,CN-为配体,Cu2+与CN-之间以配位键结合,即每个CN-与Cu2+间有1个σ键,故1 mol [Cu(CN)4]2-含有8 mol σ键。
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是_____________________________________________。
(1)1s22s22p63s23p63d64s2或[Ar]3d64s2
(2)N2 CN- C⋮⋮O C![]() O
O
(3)CH4、CH3OH CH3OH分子有极性,同时分子之间还存在着氢键
解析:(1)Fe原子的基态核外电子排布式为1s22s22p63s23p63d64s2。(2)N2、CN-与CO互为等电子体;因为N2的电子式为N⋮⋮N,所以CO的电子式为C⋮⋮O,其结构式为C![]() O(有一个配位键)。(3)CH4、CH3OH均为四面体结构,碳原子采取sp3杂化;由于CH3OH是极性分子,且存在分子间氢键,所以CH3OH的熔、沸点较高。
O(有一个配位键)。(3)CH4、CH3OH均为四面体结构,碳原子采取sp3杂化;由于CH3OH是极性分子,且存在分子间氢键,所以CH3OH的熔、沸点较高。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。
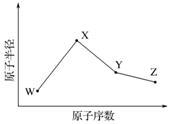
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________________________。
(1)三 ⅠA 2 (2)Si HCl (3)SiCl4+3H2O===H2SiO3↓+4HCl(其他合理答案均可)
解析:W的质子数Z=A-N=18-10=8,则W为氧;X和Ne的核外电子数相差1,且图中X的原子半径大于W,则X为钠;Y的单质是一种常见的半导体材料,则Y为硅;Z的原子序数大于Y,且在同周期主族元素中非金属性最大,则Z为氯。
(1)Na在元素周期表中位于第三周期第ⅠA族。O的基态原子的轨道表示式为![]() ,故有2个未成对电子。(2)Na的单质和Si的单质相比较,晶体Si为共价晶体,故熔、沸点高。氯的非金属性强于溴,故HCl的稳定性更强。(3)SiCl4与H2O反应的化学方程式为SiCl4+3H2O===H2SiO3↓+4HCl。
,故有2个未成对电子。(2)Na的单质和Si的单质相比较,晶体Si为共价晶体,故熔、沸点高。氯的非金属性强于溴,故HCl的稳定性更强。(3)SiCl4与H2O反应的化学方程式为SiCl4+3H2O===H2SiO3↓+4HCl。
有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成一种化合物Y2Q3
B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强,是因为前者的非羟基氧原子数目大于后者
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是极性键构成的非极性分子
C
解析:X的电子排布式为1s22s22p63s23p4,为S元素;Y的电子排布式为1s22s22p63s23p63d64s2,为Fe元素;Z的电子排布式为1s22s22p2,为C元素;Q的电子排布式为1s22s22p4,为O元素;T的电子排布式为1s22s22p63s23p3,为P元素。C项中,X与Q形成的化合物SO2或SO3都为共价化合物,故C项不正确。
本卷还有15题,登录并加入会员即可免费使用哦~

该作品由: 用户罗强分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。