利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
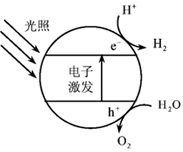
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________。
(2)若将该催化剂置于Na2SO3溶液中,产物之一为![]() ,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):![]()
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
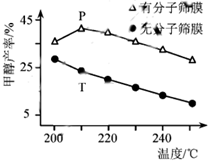
①甲醇平衡产率随温度升高而降低的原因为____________。
②P点甲醇产率高于T点的原因为___________。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________°C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) ![]() 的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,
的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,![]() =1:_______:__________。
=1:_______:__________。
(1). 光能转化为化学能 (2). H2 (3). ![]() (4).
(4). ![]() (5). 该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) (6). 分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 (7). 210 (8). 平面(正)三角形 (9).
(5). 该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) (6). 分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 (7). 210 (8). 平面(正)三角形 (9). ![]() (10).
(10). ![]()
【解析】
【分析】
I.根据图示分析反应以及能量转化形式;根据氧化还原反应的规律分析产物、书写离子反应式;
II.用三段式和平衡常数表达式计算平衡常数,依据外界条件对化学平衡的影响分析作答;
III.用价层电子对互斥理论判断![]() 的空间构型,利用电离平衡常数表达式计算粒子浓度的比值。
的空间构型,利用电离平衡常数表达式计算粒子浓度的比值。
【详解】I.(1)根据图示,该催化剂在水中发生光催化反应的方程式为2H2O 2H2↑+O2↑,光解水能量转化形式为光能转化为化学能,故答案为:光能转化为化学能。
2H2↑+O2↑,光解水能量转化形式为光能转化为化学能,故答案为:光能转化为化学能。
(2)若将该催化剂置于Na2SO3溶液中,产物之一为![]() ,
,![]() 被氧化成
被氧化成![]() ,则H+被还原为H2,即另一产物为H2;若将该催化剂置于AgNO3溶液中,产物之一为O2,氧元素的化合价升高,O2为氧化产物,则生成另一产物的反应为还原反应,由于Ag+得电子能力大于H+,故生成另一产物的离子反应式为Ag++e-=Ag,故答案为:H2,Ag++e-=Ag。
,则H+被还原为H2,即另一产物为H2;若将该催化剂置于AgNO3溶液中,产物之一为O2,氧元素的化合价升高,O2为氧化产物,则生成另一产物的反应为还原反应,由于Ag+得电子能力大于H+,故生成另一产物的离子反应式为Ag++e-=Ag,故答案为:H2,Ag++e-=Ag。
II.(3) CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,CH3OH的产率为b,则生成的CH3OH物质的量浓度为abmol/L,根据三段式
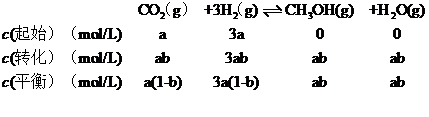
则反应的平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。
(4)①该反应为放热反应(∆H<0),温度升高,平衡逆向移动(或平衡常数减小),故甲醇平衡产率随温度升高而降低,故答案为:该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小);
②因![]() 分子筛膜能选择性分离出H2O,c(H2O)减小,有利于反应正向进行,甲醇产率升高,故P点甲醇产率高于T点,故答案为:分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高。
分子筛膜能选择性分离出H2O,c(H2O)减小,有利于反应正向进行,甲醇产率升高,故P点甲醇产率高于T点,故答案为:分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高。
③根据图示,使用该分子筛膜210℃时甲醇的产率最大,故在此条件下采用该分子筛膜时的最佳反应温度为210℃,故答案为:210。
III.(5)![]() 中C的孤电子对数为
中C的孤电子对数为![]() ×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C上没有孤电子对,故
×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C上没有孤电子对,故![]() 的空间构型为平面正三角形;H2CO3的电离方程式为H2CO3⇌H++
的空间构型为平面正三角形;H2CO3的电离方程式为H2CO3⇌H++![]() 、
、![]() ⇌ H++
⇌ H++![]() ,则Ka1=
,则Ka1=![]() 、Ka2=
、Ka2=![]() ,当溶液的pH=12时,c(H+)=1×10-12mol/L,将其代入Ka1、Ka2中分别求出c(
,当溶液的pH=12时,c(H+)=1×10-12mol/L,将其代入Ka1、Ka2中分别求出c(![]() )=1012Ka1 c(H2CO3)、c(
)=1012Ka1 c(H2CO3)、c(![]() )=1012Ka2 c(
)=1012Ka2 c(![]() )=1024Ka1Ka2 c(H2CO3),则c(H2CO3):c(
)=1024Ka1Ka2 c(H2CO3),则c(H2CO3):c(![]() ):c(
):c(![]() ) =1:(1012Ka1):(1024Ka1Ka2),故答案为:平面正三角形,1012Ka1,1024Ka1Ka2。
) =1:(1012Ka1):(1024Ka1Ka2),故答案为:平面正三角形,1012Ka1,1024Ka1Ka2。
【点睛】本题考查的知识点较多,但难度都不是很大,学生只要充分利用题给信息、结合所学的基本原理和方法即可作答。
Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________,基态Fe原子的电子排布式为__________。
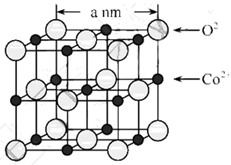
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______。
(3)Fe、Co、Ni能与C12反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______。
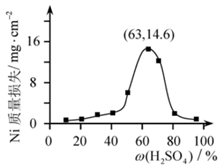
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。
(1). 第四周期第VIII族 (2). 1s22s22p63s23p63d64s2或(Ar)3d64s2 (3). ![]() (4). NiO>CoO>FeO (5). CoCl3>Cl2>FeCl3 (6). 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O (7). 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 (8). 少量多次 (9). 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
(4). NiO>CoO>FeO (5). CoCl3>Cl2>FeCl3 (6). 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O (7). 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 (8). 少量多次 (9). 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
【解析】
【分析】
(1)根据Fe、Co、Ni的原子序数得出位置和基态Fe原子的电子排布式。
(2)根据晶胞结构计算出O2−和Co2+个数,根据密度公式计算;根据离子晶体键能和晶格能比较熔点。
(3)根据反应方程式氧化剂的氧化性大于氧化产物氧化性,Co(OH)3与盐酸反应发生氧化还原反应生成Cl2、CoCl2、H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息得出原因;根据为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快这个信息得出添加硝酸的方法和反应方程式。
【详解】(1)Fe、Co、Ni分别为26、27、28号元素,它们在周期表中的位置为第四周期第VIII族,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2或(Ar)3d64s2;故答案为:第四周期第VIII族;1s22s22p63s23p63d64s2或(Ar)3d64s2;。
(2)CoO的面心立方晶胞如图1所示。根据晶胞结构计算出O2−个数为![]() ,Co2+个数为
,Co2+个数为![]() ,设阿伏加德罗常数的值为NA,则CoO晶体的密度为
,设阿伏加德罗常数的值为NA,则CoO晶体的密度为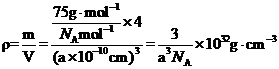 ;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:
;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:![]() ;NiO>CoO>FeO。
;NiO>CoO>FeO。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,根据铁和氯气反应生成FeCl3,氧化剂的氧化性大于氧化产物氧化性,因此氧化性:Cl2>FeCl3,氯气与Co和为Ni均生产二氯化物,说明氯气的氧化性比CoCl3弱,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为CoCl3>Cl2>FeCl3,Co(OH)3与盐酸反应有黄绿色气体生成,发生氧化还原反应生成Cl2、CoCl2、H2O,其离子方程式:2Co(OH)3+6H++2Cl-=Cl2↑+2Co2++6H2O;故答案为:CoCl3>Cl2>FeCl3;2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。
【点睛】物质结构是常考题型,主要考查电子排布式、晶胞计算、氧化还原反应、学生学习知识的能力的考查。
为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:![]()
实验步骤:
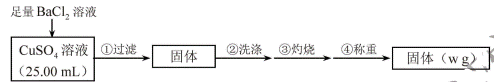
(1)判断![]() 沉淀完全的操作为____________。
沉淀完全的操作为____________。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________。
(3)步骤③灼烧时盛装样品的仪器名称为__________。
(4)固体质量为wg,则c(CuSO4)=________mol‧L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:![]() ,
,![]()

实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________。
(7)步骤⑥需保证体系恢复到室温的原因是________(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下![]() ,则c(CuSO4)______mol‧L-1(列出计算表达式)。
,则c(CuSO4)______mol‧L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。
(1). 向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全 (2). AgNO3溶液 (3). 坩埚 (4). ![]() (5). 偏低 (6). 检查装置气密性 (7). b (8).
(5). 偏低 (6). 检查装置气密性 (7). b (8). 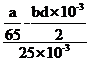 (9). 偏高 (10). 否
(9). 偏高 (10). 否
【解析】
【分析】
甲方案是利用溶液中的硫酸铜与氯化钡反应生成硫酸钡沉淀,经灼烧、洗涤、称重后得到的固体是硫酸钡,利用硫酸根守恒,计算出硫酸铜的物质的量,从而计算出浓度;乙方案是利用锌与稀硫酸反应释放出氢气的体积,换算成质量,计算出与稀硫酸反应的锌的物质的量,再利用锌的总的物质的量减去与酸反应的锌的物质的量,得到与硫酸铜反应的锌的物质的量,根据锌和硫酸铜的物质的量关系,计算出硫酸铜的物质的量,根据![]() 得到硫酸铜的浓度,据此分析。
得到硫酸铜的浓度,据此分析。
【详解】Ⅰ.(1)硫酸根离子的检验是滴加氯化钡溶液,若产生白色沉淀,证明溶液中含有硫酸根离子,故判断![]() 沉淀完全的操作向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全;
沉淀完全的操作向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全;
(2)步骤②判断沉淀是否洗净所选用的试剂为AgNO3溶液,硫酸钡沉淀中可能附着有氯化钡,为了证明还有没氯离子,需要加入硝酸银溶液,若产生白色沉淀,证明没有洗净;
(3)步骤③灼烧时盛装样品的仪器为坩埚;
(4)固体质量为wg,为硫酸钡的质量,硫酸钡的物质的量为n=![]() ,根据硫酸根守恒可知,CuSO4~BaSO4,则c(CuSO4)=
,根据硫酸根守恒可知,CuSO4~BaSO4,则c(CuSO4)=![]() =
=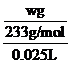 =
=![]() mol‧L-1;
mol‧L-1;
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,会使固体的质量偏小,物质的量偏小,根据![]() 可知,则测得c(CuSO4)偏低;
可知,则测得c(CuSO4)偏低;
Ⅱ.(6)加入药品之前需检查装置的气密性;步骤②为检查装置气密性;
(7)气体的体积受温度和压强的影响较大,气体的质量不随温度和压强的变化而改变,密度也受温度和压强的影响,步骤⑥需保证体系恢复到室温的原因是气体密度受温度影响;反应热不受温度的影响,只与反应物和生成物自身的能量有关,不随温度压强而改变;反应速率受温度影响,温度越高,反应速率越快,步骤⑥需保证体系恢复到室温与反应速率无关;
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下![]() ,氢气的质量=
,氢气的质量=![]() ,利用氢气的质量得到氢气的物质的量n=
,利用氢气的质量得到氢气的物质的量n=![]() ,根据
,根据![]() ,与酸反应的锌的物质的量为
,与酸反应的锌的物质的量为![]() ,锌的总物质的量为
,锌的总物质的量为![]() ,与硫酸铜反应的锌的物质的量为
,与硫酸铜反应的锌的物质的量为![]() ,根据
,根据![]() ,则c(CuSO4)=
,则c(CuSO4)=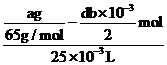 ;
;
(9)若步骤⑥E管液面高于D管,未调液面即读数,得到氢气的体积偏小,与硫酸反应的锌的质量偏小,与硫酸铜反应的锌的质量偏大,则测得c(CuSO4)偏高;
(10) 不能用同样的装置和方法测定MgSO4溶液的浓度,硫酸镁不和锌发生置换反应。
【点睛】本题甲方案计算时,需要根据硫酸根守恒,是易错点。
天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。

已知: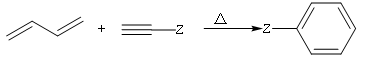 (
(![]() 等)
等)
回答下列问题:
(1)A的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结构:__________。
(2)在核磁共振氢谱中,化合物B有________组吸收峰。
(3)化合物X的结构简式为___________。
(4)D→E的反应类型为___________。
(5)F的分子式为_______,G所含官能团的名称为___________。
(6)化合物H含有手性碳原子的数目为_____,下列物质不能与H发生反应的是_______(填序号)。
a.CHCl3 b.NaOH溶液 c.酸性KMnO4溶液 d.金属Na
(7)以 和
和![]() 为原料,合成
为原料,合成![]() ,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)_______________。
,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)_______________。
(1). ![]() 、
、![]() 、
、 、
、![]() (2). 4 (3).
(2). 4 (3). ![]() (4). 加成反应 (5).
(4). 加成反应 (5). ![]() (6). 羰基、酯基 (7). 1 (8). a (9).
(6). 羰基、酯基 (7). 1 (8). a (9). 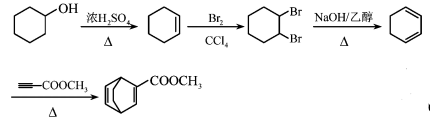
【解析】
【分析】
根据所给信息分析同分异构体结构并写出可能的同分异构体;根据有机物结构分析有机物中H原子的化学环境;根据反应前后有机物结构和分子式推断反应前反应的结构;根据已知条件判断有机反应类型;根据有机物结构判断有机物可能发生的反应;根据题目所给的合成流程和已知条件选择合适的反应路线制备目标物质。
【详解】(1) A的链状同分异构体可发生银镜反应说明该同分异构体中含有醛基,故可能的结构为
(2)根据B的结构,有机物B中含有4种不同化学环境的H原子,故在核磁共振氢谱中有4组峰;故答案为:4。
(3)根据有机物C和有机物D的结构,有机物C与有机物X发生酯化反应生成有机物D,则有机物D的结构简式为![]() ;故答案为:
;故答案为:![]() 。
。
(4) D→E为已知条件的反应,反应类型为加成反应;故答案为:加成反应。
(5)根据F的结构简式,有机物F的分子式为C13H12O3,有机物G中含有的官能团名称是酯基、羰基;故答案为:C13H12O3;酯基、羰基。
(6)根据有机物H的结构,有机物H中含有1个手性碳原子,为左下角与羟基相邻的碳原子;
有机物H中含有羟基,可以与金属Na发生反应;有机物H中含有碳碳双键,可以与酸性高锰酸钾溶液反应;有机物H中含有酯基,可以被NaOH水解;有机物H中不含与CHCl3反应的基团,故不与CHCl3反应,故选择a;故答案为:1;a。
(7)利用 和
和![]() 反应制得
反应制得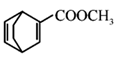 ,可先将环己醇脱水得环己烯,将环己烯(
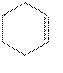
,可先将环己醇脱水得环己烯,将环己烯(![]() )与溴发生加成反应再发生消去反应制得1,3-环己二烯(
)与溴发生加成反应再发生消去反应制得1,3-环己二烯(![]() ),将1,3-环己二烯与
),将1,3-环己二烯与![]() 发生已知条件的反应制得
发生已知条件的反应制得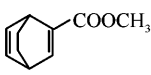 ,反应的具体流程为:
,反应的具体流程为: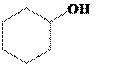
![]()
![]()
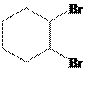
![]()
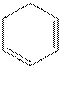
 ;故答案为:
;故答案为:
![]()

![]()
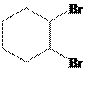
![]()

 。
。
已知(Co(H2O)6)2+呈粉红色,(CoCl4)2-呈蓝色,(ZnCl4)2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:![]() ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
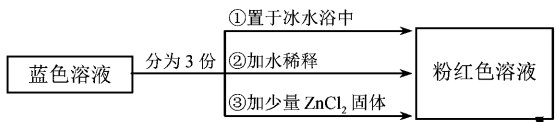
以下结论和解释正确的是
A. 等物质的量的(Co(H2O)6)2+和(CoCl4)2-中σ键数之比为3:2
B. 由实验①可推知△H<0
C. 实验②是由于c(H2O)增大,导致平衡逆向移动
D. 由实验③可知配离子的稳定性:(ZnCl4)2->(CoCl4)2-
D
【解析】
【详解】A.1个(Co(H2O)6)2+中含有18个σ键,1个(CoCl4)2-中含有4个σ键,等物质的量的(Co(H2O)6)2+和(CoCl4)2-所含σ键数之比为18:4=9:2,A错误;
B. 实验①将蓝色溶液置于冰水浴中,溶液变为粉红色,说明降低温度平衡逆向移动,则逆反应为放热反应,正反应为吸热反应,∆H>0,B错误;
C. 实验②加水稀释,溶液变为粉红色,加水稀释,溶液的体积增大,(Co(H2O)6)2+、(CoCl4)2-、Cl-浓度都减小,(Co(H2O)6)2+、Cl-的化学计量数之和大于(CoCl4)2-的化学计量数,则瞬时浓度商>化学平衡常数,平衡逆向移动,C错误;
D. 实验③加入少量ZnCl2固体,溶液变为粉红色,说明Zn2+与Cl-结合成更稳定的(ZnCl4)2-,导致溶液中c(Cl-)减小,平衡逆向移动,则由此说明稳定性:(ZnCl4)2->(CoCl4)2-,D正确;
答案选D。
【点睛】本题有两个易错点:A项中(Co(H2O)6)2+中不仅有Co2+与H2O分子间的配位键,而且每个H2O分子中还有两个O—Hσ键;C项中H2O为溶剂,视为纯液体,加水稀释,溶液体积增大,相当于利用“对气体参与的反应,增大体积、减小压强,平衡向气体系数之和增大的方向移动”来理解。
本卷还有11题,登录并加入会员即可免费使用哦~

该作品由: 用户張三分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。