国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是
A. CH3CH2OH能与水互溶
B. NaClO通过氧化灭活病毒
C. 过氧乙酸相对分子质量为76
D. 氯仿的化学名称是四氯化碳
D
【解析】
【详解】A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;
B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B说法正确;
C.过氧乙酸的分子式为C2H4O3,故其相对分子质量为76,C说法正确;
D.氯仿的化学名称为三氯甲烷,D说法不正确。
综上所述,故选D。
紫花前胡醇 可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是
可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是
A. 分子式为C14H14O4
B. 不能使酸性重铬酸钾溶液变色
C. 能够发生水解反应
D. 能够发生消去反应生成双键
B
【解析】
【详解】A.根据该有机物的分子结构可以确定其分子式为C14H14O4,A叙述正确;
B.该有机物的分子在有羟基,且与羟基相连的碳原子上有氢原子,故其可以被酸性重铬酸钾溶液氧化,能使酸性重铬酸钾溶液变色,B叙述不正确;
C.该有机物的分子中有酯基,故其能够发生水解反应,C叙述正确;
D.该有机物分子中与羟基相连的碳原子的邻位碳原子上有氢原子,故其可以在一定的条件下发生消去反应生成碳碳双键,D叙述正确。
综上所述,故选B。
下列气体去除杂质的方法中,不能实现目的的是
| 气体(杂质) | 方法 | |
| A | SO2(H2S) | 通过酸性高锰酸钾溶液 |
| B | Cl2(HCl) | 通过饱和的食盐水 |
| C | N2(O2) | 通过灼热的铜丝网 |
| D | NO(NO2) | 通过氢氧化钠溶液 |
A. A B. B C. C D. D
A
【解析】
【详解】A.SO2和H2S都具有较强的还原性,都可以被酸性高锰酸钾溶液氧化;因此在用酸性高锰酸钾溶液除杂质H2S时,SO2也会被吸收,故A项不能实现除杂目的;
B.氯气中混有少量的氯化氢气体,可以用饱和食盐水除去;饱和食盐水在吸收氯化氢气体的同时,也会抑制氯气在水中的溶解,故B项能实现除杂目的;
C.氮气中混有少量氧气,在通过灼热的铜丝网时,氧气可以与之发生反应:![]() ,而铜与氮气无法反应,因此可以采取这种方式除去杂质氧气,故C项能实现除杂目的;
,而铜与氮气无法反应,因此可以采取这种方式除去杂质氧气,故C项能实现除杂目的;
D.NO2可以与NaOH发生反应:![]() ,NO与NaOH溶液不能发生反应;尽管NO可以与NO2一同跟NaOH发生反应:
,NO与NaOH溶液不能发生反应;尽管NO可以与NO2一同跟NaOH发生反应:![]() ,但由于杂质的含量一般较少,所以也不会对NO的量产生较大的影响,故D项能实现除杂的目的;
,但由于杂质的含量一般较少,所以也不会对NO的量产生较大的影响,故D项能实现除杂的目的;
答案选A。
【点睛】除杂操作原则可概括为“不多不少,简单最好”:首先,避免引入新的杂质;其次,尽量避免产品的损失;最后,方法越简单越好。
铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
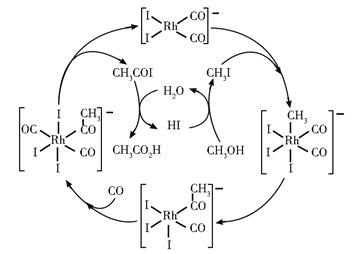
下列叙述错误的是
A. CH3COI是反应中间体
B. 甲醇羰基化反应为CH3OH+CO=CH3CO2H
C. 反应过程中Rh的成键数目保持不变
D. 存在反应CH3OH+HI=CH3I+H2O
C
【解析】
【分析】
题干中明确指出,铑配合物![]() 充当催化剂的作用,用于催化甲醇羰基化。由题干中提供的反应机理图可知,铑配合物在整个反应历程中成键数目,配体种类等均发生了变化;并且也可以观察出,甲醇羰基化反应所需的反应物除甲醇外还需要CO,最终产物是乙酸;因此,凡是出现在历程中的,既非反应物又非产物的物种如CH3COI以及各种配离子等,都可视作中间物种。
充当催化剂的作用,用于催化甲醇羰基化。由题干中提供的反应机理图可知,铑配合物在整个反应历程中成键数目,配体种类等均发生了变化;并且也可以观察出,甲醇羰基化反应所需的反应物除甲醇外还需要CO,最终产物是乙酸;因此,凡是出现在历程中的,既非反应物又非产物的物种如CH3COI以及各种配离子等,都可视作中间物种。
【详解】A.通过分析可知,CH3COI属于甲醇羰基化反应的反应中间体;其可与水作用,生成最终产物乙酸的同时,也可以生成使甲醇转化为CH3I的HI,A项正确;
B.通过分析可知,甲醇羰基化反应,反应物为甲醇以及CO,产物为乙酸,方程式可写成:![]() ,B项正确;
,B项正确;
C.通过分析可知,铑配合物在整个反应历程中,成键数目,配体种类等均发生了变化,C项不正确;
D.通过分析可知,反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成:![]() ,D项正确;
,D项正确;
答案选C。
【点睛】对于反应机理图的分析,最基本的是判断反应物,产物以及催化剂;一般的,催化剂在机理图中多是以完整的循环出现的;反应物则是通过一个箭头进入整个历程的物质;而产物一般多是通过一个箭头最终脱离整个历程的物质。
1934年约里奥–居里夫妇在核反应中用α粒子(即氦核![]() )轰击金属原子
)轰击金属原子![]() ,得到核素
,得到核素![]() ,开创了人造放射性核素的先河:
,开创了人造放射性核素的先河:![]() +
+![]() →
→![]() +
+![]() 。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A. ![]() 的相对原子质量为26
的相对原子质量为26
B. X、Y均可形成三氯化物
C. X的原子半径小于Y的
D. Y仅有一种含氧酸
B
【解析】
【分析】
原子轰击实验中,满足质子和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,且元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子为a+2,解得a=3,因此X为Al,Y为P,以此解答。
【详解】A.![]() 的质量数为27,则该原子相对原子质量为27,故A错误;
的质量数为27,则该原子相对原子质量为27,故A错误;
B.Al元素均可形成AlCl3,P元素均可形成PCl3,故B正确;
C.Al原子与P原子位于同一周期,且Al原子序数大于P原子序数,故原子半径Al>P,故C错误;
D.P的含氧酸有H3PO4、H3PO3、H3PO2等,故D错误;
故答案为:B。
本卷还有7题,登录并加入会员即可免费使用哦~

该作品由: 用户nancy分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。