下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 向滴有甲基橙的AgNO3溶液中滴加KC1溶液 | 溶液由红色变为黄色 | KC1溶液具有碱性 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为 CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
A. A B. B C. C D. D
C
【解析】
A.硅酸钠水解呈碱性,滴加酚酞变红色,向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,试管里出现凝胶,可说明生成硅酸,可说明盐酸的酸性比硅酸强,盐酸不是氯元素最高价氧化物对应水化物,则无法得出非金属性:Cl>Si的结论,故A错误;B.硝酸银为强酸弱碱盐,水解呈酸性,加入KCl生成AgCl沉淀,银离子浓度减小,酸性减弱,导致溶液由红色变为黄色,而KCl溶液呈中性,故B错误;C.CuSO4溶液中加入KI溶液,发生氧化还原反应生成碘,且有白色沉淀生成,可为CuI,故C正确;D.取久置的Na2O2粉末,向其中滴加过量的盐酸,过氧化钠与盐酸反应生成氯化钠、水和氧气,碳酸钠与稀盐酸也能产生无色气体CO2,可知无论是否变质,均有无色气体产生,则该方法无法证明过氧化钠是否变质,故D错误;故答案为C。
银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是
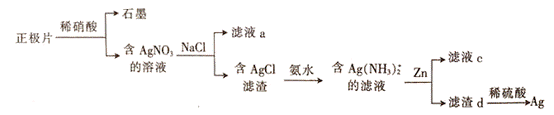
A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3·H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
C
【解析】
【分析】
正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
【详解】A.正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3·H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。
,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3·H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。
《战争的气体化学和分析》中介绍了一种制取COC12(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略)。已知:3CCl4+2H2SO4(浓) ![]() 3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是
3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是
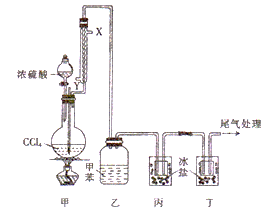
A. 该反应属于氧化还原反应
B. 自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C. 可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D. 装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
D
【解析】
A. 反应3CCl4+2H2SO4(浓) ![]() 3COCl2↑+4HCl+ S2O5Cl2中各元素化合价均不变,不属于氧化还原反应,选项A错误;B. 自来水从冷凝管的Y口通入,且被冷凝的物质是COC12,选项B错误;C. 若将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理,因尾气中含有氯化氢,容易引起倒吸,应用倒扣的漏斗,选项C错误;D. 装置乙中可收集到光气的甲苯溶液, 光气,熔点为-118℃,沸点为8.2℃,装置丙、丁均可收集到液态光气,选项D正确。答案选D。
3COCl2↑+4HCl+ S2O5Cl2中各元素化合价均不变,不属于氧化还原反应,选项A错误;B. 自来水从冷凝管的Y口通入,且被冷凝的物质是COC12,选项B错误;C. 若将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理,因尾气中含有氯化氢,容易引起倒吸,应用倒扣的漏斗,选项C错误;D. 装置乙中可收集到光气的甲苯溶液, 光气,熔点为-118℃,沸点为8.2℃,装置丙、丁均可收集到液态光气,选项D正确。答案选D。
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2 能使溶液复原,则电解过程中转移电子的数目为0.9NA
B. 0.1molNa2O2与过量的CO2和H2O混合气体充分反应后,放出的O2为0.2NA
C. 常温常压下,1molSiO2晶体中有2NA个Si-O键
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
D
【解析】
【详解】A..29.4 gCu(OH)2 物质的量=![]() =0.3mol,0.3mol的Cu(OH)2相当于0.3molCuO和0.3moH2O,进入溶液的是0.6molO原子,说明阳极上生成的是0.3mol氧气,则转移的电子的物质的量为0.3mol×4=1.2mol,即1.2NA个,故A错误;
=0.3mol,0.3mol的Cu(OH)2相当于0.3molCuO和0.3moH2O,进入溶液的是0.6molO原子,说明阳极上生成的是0.3mol氧气,则转移的电子的物质的量为0.3mol×4=1.2mol,即1.2NA个,故A错误;
B. 根据2Na2O2 + 2H2O = 4NaOH + O2 ↑,2Na2O2 +2CO2 == 2Na2CO3 + O2,可知0.1molNa2O2与过量的CO2和H2O混合气体充分反应后,放出0.05molO2,故B错误;
C、在SiO2晶体中,1个Si原子结合4个O原子,故1molSiO2晶体含有4molSi-O键,故C错误;
D、H218O与2H2O的摩尔质量均为20g/mol,故18gH218O与2H2O的物质的量均为0.9mol,而两者中均含10个中子,故0.9mol混合物中含9mol中子,即9NA个,故D正确;
答案选D。
下列各组物质间可能包括多步反应,其总的离子方程式正确的是 ( )
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 向 AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
C
【解析】
【详解】A.次氯酸钠具有强氧化性,会与SO2发生氧化还原反应,反应的离子方程式为:ClO-+SO2+H2O═2H++Cl-+SO42-,故A错误;
B.还原性Fe2+>Br-,向FeBr2溶液中通入少量Cl2,亚铁离子被氯气氧化,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故B错误;
C.向AlCl3溶液中投入过量Na,反应生成了偏铝酸根离子和氢气,反应![]() 离子方程式为Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故C正确;
离子方程式为Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故C正确;
D.溶液中钡离子与硫酸根离子的物质的量相等,此时Al元素以AlO2-的形式存在,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2H2O+2BaSO4↓,故D错误;
答案:C。
【点睛】本题考查离子反应方程式的正误判断,明确发生的化学反应是解答本题的关键,易错选项B,注意还原性强弱顺序的应用。
本卷还有13题,登录并加入会员即可免费使用哦~

该作品由: 用户罗丹分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。