如图所示,食盐晶体由钠离子和氯离子构成。已知食盐的M=58.5 g·mol-1,食盐的密度是2.2 g·cm-3,阿伏加德罗常数为6.0 ×1023 mol-1,在食盐晶体中两个距离最近的钠离子中心间的距离最接近下列哪个数据( )
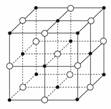
A.3.0×10-8 cm B.3.5×10-8 cm
C.4.0×10-8 cm D.5.0×10-8 cm
答案 C
解析 从图中可看出,顶点上的每个离子为8个小立方体所共有,因此每个小立方体实际上只能分摊得![]() 个“NaCl”。设每个小立方体的边长为a。则(2a)3×2.2 g·cm-3×6.0×1023 mol-1=58.5 g·mol-1×4。所以,两个距离最近的钠离子中心间的距离约为4.0×10-8cm。
个“NaCl”。设每个小立方体的边长为a。则(2a)3×2.2 g·cm-3×6.0×1023 mol-1=58.5 g·mol-1×4。所以,两个距离最近的钠离子中心间的距离约为4.0×10-8cm。
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子间距离/10-10 m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
答案 B
解析 NaF、NaI、MgO均为离子晶体,它们熔点高低由离子键强弱决定,而离子键的强弱与离子间距离和离子电荷数有关,MgO中离子间距离最短,离子电荷数最高,故离子键最强。
离子晶体不可能具有的性质是( )
A.较高的熔沸点 B.良好的导电性
C.溶于极性溶剂 D.坚硬而易粉碎
答案 B
解析 离子晶体是阴、阳离子通过离子键形成的晶体,无自由移动的离子,不能导电,在熔融态或水溶液中能导电。
下列性质中,可以较充分说明某晶体是离子晶体的是( )
A.具有较高的熔点
B.固态不导电,水溶液能导电
C.可溶于水
D.固态不导电,熔融状态能导电
答案 D
解析 A选项,有些金属晶体熔点也较高;B选项,有些共价化合物如HCl的水溶液也能导电;C选项,有些共价化合物也溶于水;共价化合物在液态时不导电,离子晶体在熔融时可导电。
下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
答案 C
本卷还有18题,登录并加入会员即可免费使用哦~

该作品由: 用户庄子分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。