下列符号不符合事实的是
A. 4s2 B. 2p3 C. 3d8 D. 3f14
【答案】D
【解析】
s能级最多排列2个电子、p能级最多排列6个电子、d能级最多排列10个电子,存在4s2、2p3、3d8排布,f能级最多排列14个电子,第三能层没有f能级,至少在第四能层才存在f能级,不可能存3f14排布,故选D。
点睛:本题考查了原子核外电子排布,明确能层、能级、轨道数的关系及每种能级上最多排列电子数是解题的关键。本题要注意至少在第四能层才存在f能级。
在单质![]() 晶体中一定不存在
晶体中一定不存在
A. 离子键 B. 分子间作用力
C. 共价键 D. 金属离子与自由电子间的作用
【答案】A
【解析】
试题分析:A、离子键是阴阳离子通过静电作用,存在于化合物中,故正确;B、像氧气等中存在分子间作用力,故错误;C、如氧气中,氧原子间存在共价键,故错误;D、如金属晶体,故错误。
考点:考查晶体的成键特点等知识。
下列物质属于分子晶体的是
A. 二氧化硅 B. 碘 C. 镁 D. NaCl
【答案】B
【解析】
试题分析:A、属于原子晶体,故错误;B、碘属于分子晶体,故正确;C、镁属于金属晶体,故错误;D、氯化钠属于离子晶体,故错误。
考点:考查晶体等知识。
能正确表示CH4中碳原子成键方式的电子排布图为
A. 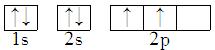 B.
B. 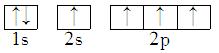
C. 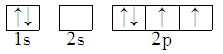 D.
D. 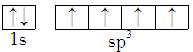
【答案】C
【解析】
分析:根据杂化轨道理论,CH4中碳原子的价层电子对数为(4+1×4)/2=4,所以碳原子是sp3杂化,据此答题。
详解:A、轨道没有杂化,还是基态原子的排布,A错误;
B、杂化后的轨道能量应当相同,B错误;
C、CH4中碳原子的价层电子对数为(4+1×4)/2=4,所以碳原子是sp3杂化,即由一个s轨道和3个p轨道杂化后形成4个能量相同的轨道,根据洪特规则,每个轨道上有一个电子,C正确;
D、电子排布时应先排在能量低的轨道里,D错误;
答案选C。
按F、Cl、Br、I顺序递增的是
A. 外围电子 B. 原子半径 C. 电负性 D. 第一电离能
【答案】B
【解析】
【详解】A.F、Cl、Br、I为第VIIA族元素,同主族外围电子数相同,故A不选;
B.同主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,则F、Cl、Br、I原子半径逐渐增大,故B选;
C.同主族,从上到下,电负性减弱,则F、Cl、Br、I电负性逐渐减小,故C不选;
D.同主族,从上到下,第一电离能减小,则F、Cl、Br、I第一电离能逐渐减小,故D不选;
答案选B。
本卷还有22题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。