2019四川人教版(2019)高中化学单元测试135870
高中
整体难度:中等
2019-12-03
题号
一
二
三
四
五
评分
一、选择题 (共7题)
添加该题型下试题
2.
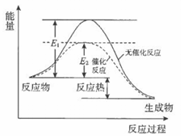
过氧化氢分解反应过程中,能量变化如图所示:下列说法正确的是
A.催化剂可以改变过氧化氢分解反应的焓变
B.催化剂使正、逆反应的活化能都降低了
C.催化剂不能改变反应路径
D.H2O2分解是吸热反应
难度:
知识点:化学反应中的能量变化
使用次数:124
【答案】
B
3.
我国工业废水中几种污染物即其最高允许排放浓度如下表。下列说法不正确的是
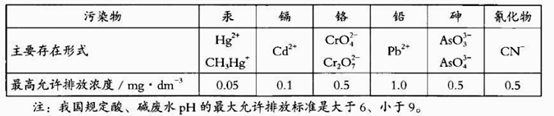
A. Hg2+、Cd2+、Pb2+是重金属离子
B. 对于pH>9的废水可用中和法处理
C.将CrO42-转化为Cr2O72-是用氧化还原的方法
D. 在含有Hg2+的废水中加入Na2S,可使转变为沉淀而除去
难度:
知识点:电离平衡单元测试
使用次数:172
【答案】
C
4.
根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向盛某盐溶液的试管中滴入氢氧化钠溶液后,试管口处湿润的红色石蕊试纸未变蓝 | 该盐中不含NH4+ |
| B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,振荡静置,下层呈紫红色 | Fe3+氧化性强于I2 |
| C | 向蛋白质溶液中加入硫酸钠溶液,有沉淀出现 | 蛋白质发生变性 |
| D | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 溶液中 |
难度:
知识点:电离平衡 水解平衡
使用次数:100
【答案】
B
5.
设NA为阿伏伽德罗常数的值,则下列说法正确的是
A.常温常压下,17g甲基(-14CH3)所含的中子数为 11NA
B.ToC时,pH=1的盐酸中含有的H+数为NA
C.1molSO2溶于足量水,溶液中H2SO3、HSO3-与SO32-粒子的物质的量之和为NA
D.1molCnH2n(n≥2)含有的共用电子对数目为3nNA
难度:
知识点:物质的量单元测试
使用次数:117
【答案】
D
本卷还有5题,登录并加入会员即可免费使用哦~
立即下载
全选试题
编辑试卷
收藏试卷

试题总数:
10
总体难度:
中等
难度统计
难度系数
数量
占比
容易
3
30.0%
中等
7
70.0%
题型统计
大题类型
数量
占比
选择题
7
70.0%
实验,探究题
1
10.0%
填空题
1
10.0%
综合题
1
10.0%
知识点统计
知识点
数量
占比
氧化还原反应
1
10.0%
化学反应中的能量变化
1
10.0%
电离平衡单元测试
2
20.0%
电离平衡 水解平衡
2
20.0%
物质的量单元测试
2
20.0%
物质的分离 提纯和检验
1
10.0%
化学反应速率 化学平衡
1
10.0%
版权提示
该作品由: 用户凌松分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。