硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
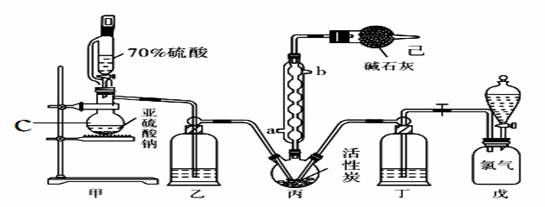
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。
回答下列问题:
(1)仪器C的名称是_______________,冷凝管的进水方向______(填“a”或“b”)。
(2)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 mol·L-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:_____________。
(4)长期储存的硫酰氯会发黄,可能的原因是_________________________(用化学方程式和必要的文字加以解释)。
(5)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为_______。(产率=![]() ×100%)
×100%)
【答案】蒸馏烧瓶aBD2ClSO3H![]() SO2Cl2 + H2SO4SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中75%
SO2Cl2 + H2SO4SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中75%
【解析】(1)仪器C为蒸馏烧瓶,冷凝水的流向是“下进上出”,所以装置丙的冷凝管中冷凝水的入口是a;

五氯化磷(PCl5) 常温下是一种淡黄色固体,在潮湿空气中水解产生两种酸。PCl5在有机合成中被广泛用作氯化剂、催化剂、脱水剂等,高纯度PCl5主要用于医药中间体及锂电池原材料的合成。工业生产PCl5的传统方法是在搅拌式反应釜中注入液体三氯化磷(PCl3),再通入氯气在合适的温度下发生反应:PCl3+Cl2![]() PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
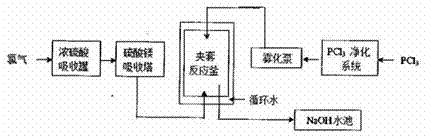
请回答下列相关问题。
(1)工业生产氯气的主要方法的离子方程式是___________,利用该反应所得产品可继续生产_________(任写一种)等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是______________________,若去掉这两个设备夹套反应釜中发生的主要副反应是______________________________。
(3)夹套反应釜中的原料混合方式与搅拌式反应釜相比主要优点是____________________________。 (4)NaOH水池的作用是_______________________,从降低生产成本的角度考虑NaOH 溶液可更换为______。
(5)生产过程中PCl3的加料速率会对生产造成明显的影响,具体情况如下表。根据表中数据判断最佳的加料速率范围是_________________kg·h-1。
| PCl3加料速率/kg·h-1 | PCl5状态 | 热交换情况 | 生产500kg产品的周期/h |
| 40 | 致密、坚硬、造粒困难 | 快、温度可控 | 11.5 |
| 50 | 致密、坚硬、造粒困难 | 快、温度可控 | 9.2 |
| 60 | 较松散、造粒容易 | 较快、温度可控 | 7.2 |
| 70 | 松散、造粒容易 | 较快、温度可控 | 6.5 |
| 80 | 松散、造粒容易 | 慢、温度升高难以控制 | 5.3 |
【答案】 )2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 盐酸或漂白液或NaClO溶液 干燥氯气 PCl5+4H2O=H3PO4+5HCl 或 PCl5+3H2O=HPO3+5HCl 反应物接触更充分,反应速率更快(合理即可) 吸收剩余的氯气,防止污染空气 石灰乳 60~70
2OH-+H2↑+Cl2↑ 盐酸或漂白液或NaClO溶液 干燥氯气 PCl5+4H2O=H3PO4+5HCl 或 PCl5+3H2O=HPO3+5HCl 反应物接触更充分,反应速率更快(合理即可) 吸收剩余的氯气,防止污染空气 石灰乳 60~70

四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。
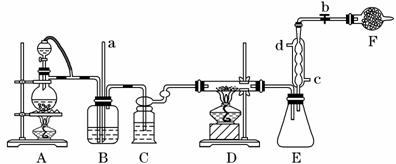
资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)检查该装置气密性的方法是_______________________________________________。
(2)实验中B装置的作用是____________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E处球形冷凝管的冷却水应从________(填“c”或“d”)口通入。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
【答案】在B装置中加入蒸馏水至浸没玻璃导管a的下端,关闭活塞b,微热A装置中的烧瓶,若导管a中的液面上升一定的高度,则气密性良好(或在B装置中加入蒸馏水至浸没玻璃导管a的下端,F装置处连接导气管并将尾端放到水槽中,微热A装置中的烧瓶,水槽中导气管的尾端有气泡冒出,停止加热,倒吸形成一段稳定的水柱,则气密性良好等合理即可)洗去Cl2中的HCl气体、用作安全瓶(或用作平衡气压的安全装置,或用作防堵塞的安全装置)TiO2+2Cl2+2C 650~850℃ TiCl4+2COTiCl4+2H2O===TiO2+4HCl↑c碱石灰没有对CO进行尾气处理
 (6)在制备TiCl4过程中,会产生有毒气体CO,不能被碱石灰吸收,直接排放到空气中,污染空气;正确答案:没有对CO进行尾气处理。
(6)在制备TiCl4过程中,会产生有毒气体CO,不能被碱石灰吸收,直接排放到空气中,污染空气;正确答案:没有对CO进行尾气处理。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
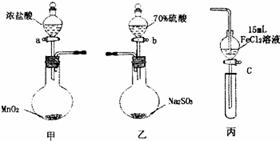
实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑70%的硫酸中c(H+)比98%的硫酸大2Fe3++SO2+2H2O=2Fe2++SO42-+4H+I、Ⅲ
MnCl2+2H2O+Cl2↑70%的硫酸中c(H+)比98%的硫酸大2Fe3++SO2+2H2O=2Fe2++SO42-+4H+I、Ⅲ

在有机化学中,硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
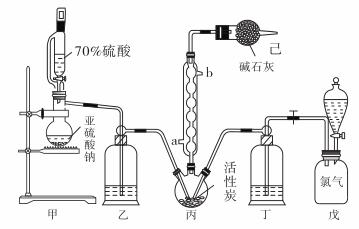
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是_____________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
【答案】 三颈烧瓶 冷凝回流导气 观察乙、丁导管口产生气泡的速度相等 B SO2Cl2+2H2O==H2SO4+2HCl C SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中 75% 取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸
 给信息,进行如下操作:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。正确答案:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。
给信息,进行如下操作:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。正确答案:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。
本卷还有9题,登录并加入会员即可免费使用哦~

该作品由: 用户秦琴分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。