氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g)⇌Cl2(aq) K1=10-1. 2 ;Cl2(aq)+H2O⇌HClO+H++Cl- K2=10-3. 4 ;HClO⇌H++ClO- Ka=?。氯水中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )

A. Cl2(g)+H2O⇌2H++ClO-+Cl- K=10-10 . 9
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
【答案】C

常温下,改变0.lmol/L的H2R溶液的pH,溶液中“R”相关的微粒的分布系数δ(X)随pH的变化如图所示[已知![]() ],下列有关说法中正确的是( )
],下列有关说法中正确的是( )
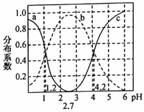
A. pH>2.7时,溶液中c(HR-)<c(R2-) B. 曲线b表示H2R的分布系数
C. K1(H2R)∶K2(H2R)=1000∶1 D. pH=1.2时,2c(R2-![]() )+c(HR-)+c(OH-)=c(H+)
)+c(HR-)+c(OH-)=c(H+)
【答案】C

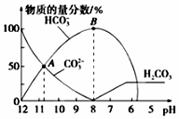
常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是

A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
【答案】D
【解析】A、根据示意图可知,当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),A错误;B、根据物料守恒可得NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(CO32-)+c(H2CO3)+c(HCO3-),因为NH4+发生水解反应,所以c(HCO3-)≠c(CO32-)+c(OH-)—c(H+),则B项中关系式错误,B错误;C、根据图像可知pH<7.8时,往该溶液中逐滴滴加氢氧化钠HCO3﹣浓度逐渐增大,C错误;D、因为0.1mol/L的NH4HCO3溶液pH=7.8,说明HCO3‾的水解程度大于NH4+的水解程度,根据越弱越水解的规律可得:Kb(NH3·H2O)>Ka1(H2CO3),D正确。答案选D。
常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
【答案】A

常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如右图所示。下列表述不正确的是

A. HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. 常温下HF的K=1×10-3.4,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/L NaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
【答案】B

本卷还有21题,登录并加入会员即可免费使用哦~

该作品由: 用户时文娟分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。