已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L 0.2mol·L-1 HF溶液中加入1L 0.2mol·L-1 CaCl2溶液,则下列说法正确的是
A. 25℃时,0.1mol·L-1 HF溶液的pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
【答案】D

已知悬浊液中存在平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②温度一定时,溶液中c(Ca2+)•c2(OH-)为定值
③向溶液中加入少量碳酸钠粉末能增大c(Ca2+)
④恒温下,向饱和溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入少量NaOH固体,Ca(OH)2 固体质量不变。
⑦向溶液中加入Na2CO3溶液,其中固体质量增加.
A. ①②⑦ B. ①②⑦⑧ C. ③④⑤⑦ D. ①③⑦⑧
【答案】A
【解析】①已知反应的△H<0,所以该反应为放热反应,升高温度,平衡逆向移动,故①正确;
②溶度积Ksp只跟温度有关,温度一定时,溶液中c(Ca2+)•c2(OH-)为定值,故②正确;
③加入碳酸钠粉末会生成CaCO3,使Ca2+浓度减小,故③错误;
④恒温下Ksp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,故④错误;
⑤加热,Ca(OH)2的溶解度减小,溶液的pH降低,故⑤错误;
⑥加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,故⑥错误;
⑦加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,故⑦正确。
所以正确的只有①②⑦,故选A。
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是
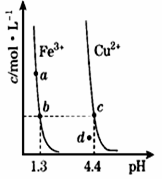
A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
【答案】C

25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
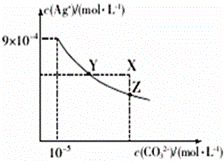
A. Ag2CO3的Ksp为8.1×10-12
B. Ag2CO3(s)+2Cl-(aq)⇌2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C. 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点)
D. 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
【答案】D

下表是五种银盐的溶度积常数(25°C),下列说法错误的是

A. 用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂
B. 将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀
C. 氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动
【答案】A
【解析】A. 由于硫化银的溶度积比氯化银小,所以用硝酸银溶液测定Cl-含量时,不能用硫化钠做指示剂,应该用铬酸钾作指示剂,所以A选项是错误的;B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,所以B选项是正确的;C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可以知道AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,所以C选项是正确的;D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,所以D选项是正确的。
本卷还有21题,登录并加入会员即可免费使用哦~

该作品由: 用户闫蕊分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。