其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
【答案】B
【解析】
【分析】
用有效碰撞理论解释外因对化学反应速率的影响。
【详解】化学反应速率的定义v=![]() =
=![]() 表明,单位时间、单位体积内有效碰撞的次数(Δn)增加,化学反应速率才能增大。只有活化分子才可能发生有效碰撞。
表明,单位时间、单位体积内有效碰撞的次数(Δn)增加,化学反应速率才能增大。只有活化分子才可能发生有效碰撞。
A项:单位体积内活化分子数增加,才能加快反应速率。A项错误;
B项:增大反应物浓度,使单位体积内活化分子数增多,单位时间、单位体积内有效碰撞的次数增加,即化学反应速率增大。B项正确;
C项:增大反应物浓度,不能改变活化分子百分数。C项错误;
D项:不是单位时间内,反应速率不一定增大。D项错误。
本题选B。
已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。现有以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l)
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)
④CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l)
其中放出的热量为57.3 kJ的是
A. ①和② B. ③ C. ④ D. 以上都不对
【答案】D
【解析】
【分析】
根据热化学方程式的含义、中和热的概念分析判断。
【详解】“H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1”表明,稀溶液中1molH+和1molOH-反应生成1mol H2O(l)时放热57.3 kJ。
①式:2molH+和2molOH-反应生成2molH2O(l),放热114.6 kJ。
②式:生成2molH2O(l)放热114.6 kJ,生成1mol BaSO4(s)也放热。总放热多于114.6kJ。
③式:NH3·H2O电离吸热,故生成1molH2O(l)时放热少于57.3 kJ。
④式:CH3COOH、NH3·H2O电离吸热,使生成1molH2O(l)时放热少于57.3 kJ。
本题选D。
【点睛】热化学方程式有三个特点:(1)用“s、l、g、aq”注明物质状态;(2)化学计量数只表示物质的量,可为分数;(3)ΔH包括符号(+吸热、-放热)、数值、单位(kJ·mol-1,指每摩化学反应),ΔH与化学计量数成正比例。
对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
A. 该反应的反应热为△H=-5800kJ/mol,是放热反应
B. 该反应的△H与各物质的状态有关,与化学计量数也有关
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol
【答案】D
【解析】
试题分析:燃烧热是指完全燃烧1mol可燃物的时候所放出的热量,由此可知丁烷的燃烧热为2900kJ/mol,因此,D错误。
考点:考查反应热问题。
在2L密闭容器中,发生3A(g)+B(g)![]() 2C(g)反应,若最初加入A和B都是4mol,10s内A 的平均反应速率为0.12mol/(L•s),则10秒钟时容器中的B是
2C(g)反应,若最初加入A和B都是4mol,10s内A 的平均反应速率为0.12mol/(L•s),则10秒钟时容器中的B是
A. 2.8mol B. 1.6mol C. 3.2mol D. 3.6mol
【答案】C
【解析】
【分析】
根据化学反应速率的定义、反应速率与化学计量数的关系进行计算。
【详解】10s内v(A)=0.12mol/(L•s),则v(B)=0.04mol/(L•s)。据v(B)=![]() =
=![]() ,得Δn(B)=0.04mol/(L•s)×2L×10s=0.8mol。则10秒钟时容器中有3.2molB。
,得Δn(B)=0.04mol/(L•s)×2L×10s=0.8mol。则10秒钟时容器中有3.2molB。
本题选C。
分析下图的能量变化,确定该反应的热化学方程式书写正确的是
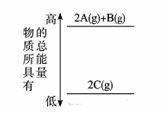
A. 2A(g)+B(g)===2C(g) ΔH<0
B. 2A(g)+B(g)===2C(g) ΔH>0
C. 2A+B===2C ΔH<0
D. 2C===2A+B ΔH<0
【答案】A
【解析】
【分析】
根据反应热与反应物总能量、生成物总能量的关系分析解答。
【详解】题图表示2molA(g)和1molB(g)具有的总能量高于2molC(g)具有的总能量,则可写热化学方程式:2A(g)+B(g)=2C(g) ΔH<0,或2C(g)=2A(g)+B(g) ΔH>0 。A项正确、B项错误;C项、D项都未写物质状态,都错误。
本题选A。
【点睛】反应热ΔH=生成物总能量-反应物总能量。ΔH是变化过程中各种形式能量之总和,而不仅指热量。
本卷还有16题,登录并加入会员即可免费使用哦~

该作品由: 用户林筱灵分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。