工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原理:CH2=CH2(g)
+H2O(g)=CH3CH2OH(g)△H。已知几种共价键的键能如下:
| 化学键 | C-H | C=C | H-O | C-C | C-O |
| 键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
【答案】D

己知反应:2A(l) ![]() B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
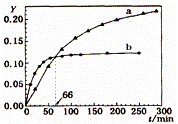
A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
【答案】B
【解析】温度越高,化学反应速率越快,反应就先达到平衡,即曲线先出现拐点,故b代表20℃下A的Y-t曲线,A项错误;反应到66min时,0℃和20℃下的转化率相同,因二者的起始量相同,故此时放出的热量相等,B项正确;2A(l) ![]() B(l) △H=-QkJ/mol表示2molA完全反应放出QkJ热量,因无法知道具体有多少A物质已经反应,故放出热量也无法计算,C项错误;b是代表20℃下的Y-t曲线,a是代表0℃下的Y-t曲线,升高温度,化学反应速率加快,故反应都达到平衡后,正反应速率a< b,D项错误。
B(l) △H=-QkJ/mol表示2molA完全反应放出QkJ热量,因无法知道具体有多少A物质已经反应,故放出热量也无法计算,C项错误;b是代表20℃下的Y-t曲线,a是代表0℃下的Y-t曲线,升高温度,化学反应速率加快,故反应都达到平衡后,正反应速率a< b,D项错误。
下列说法正确的是( )
A. 准确量取24.00mL的液体可选用移液管、量筒或滴定管
B. 配制0.1000mol•L-1碳酸钠溶液时,将溶液转移到容量瓶中需用玻璃棒引流
C. 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率
D. 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率
【答案】B

在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒, 以N2O4的浓度变化表示的平均反应速率为0.01 mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O4 0.20 mol
D. 平衡时, 如果再充入一定量N2O4, 则可提高N2O4的转化率
【答案】C
【解析】A项,前2秒,以NO2的浓度变化表示的平均反应速率为![]() =0.01mol/(L·s)
=0.01mol/(L·s)
,则以N2O4浓度变化表示的平均反应速率为0.005mol/(L·s),故A项错误;B项2秒时,NO2的浓度为0.02 mol/L,其物质的量为0.02 mol/L×5L=0.1mol,则容器内气体的总物质的量为0.5mol-0.05mol+0.1mol=0.55mol,容器内的压强为反应前的![]() =1.1倍,故B项错误;C项,平衡时,体系内的总物质的量为0.5mol×1.6=0.8mol,设剩余N2O4的物质的量为xmol,则有(0.5-x)×2+x=0.8,解得x=0.2mol,即体系内含0.2mol N2O4,故C项正确;D项,平衡时,若往容器内充入N2O4气体,相当于在原来的基础上缩小体积,由N2O4═2NO2,则缩小体积,压强增大,化学平衡逆向移动,N2O4的转化率降低,故D项错误。
=1.1倍,故B项错误;C项,平衡时,体系内的总物质的量为0.5mol×1.6=0.8mol,设剩余N2O4的物质的量为xmol,则有(0.5-x)×2+x=0.8,解得x=0.2mol,即体系内含0.2mol N2O4,故C项正确;D项,平衡时,若往容器内充入N2O4气体,相当于在原来的基础上缩小体积,由N2O4═2NO2,则缩小体积,压强增大,化学平衡逆向移动,N2O4的转化率降低,故D项错误。
氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例):
CF2Cl2![]() CF2Cl+Cl Cl+O3→ClO+O2
CF2Cl+Cl Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯) ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClO![]() ClOOC1的反应中有非极性键的形成
ClOOC1的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
【答案】C

本卷还有18题,登录并加入会员即可免费使用哦~

该作品由: 用户邓银忠分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。