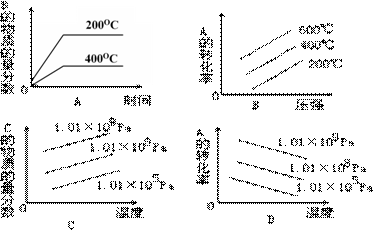
已知:一定条件下。向A、B两个恒容密闭容器中分别加入等量的X,发生反应2X(g)![]() 2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )
2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )
A. 若A、B容积相同,但反应温度不同,且温度:A>B
B. 若A、B反应温度相同,但容积不同,且容积:A<B
C. a,c两点对应的平均相对分子质量:a>c
D. t1−t2时间段内,A、B两容器中平均反应速率相等
【答案】D

H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
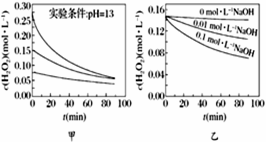
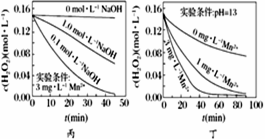
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
【答案】D

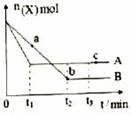
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )
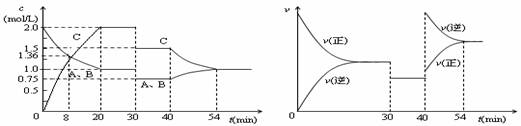
A. 第8min末 A的反应速率为0.08mol·L-1·min-1
B. 在0-54分钟的反应过程中该可逆反应的平衡常数始终为4
C. 30min时改变的条件是减小压强,40min时改变的条件是降低温度
D. 反应方程式中的x=1,且正反应为放热反应
【答案】D
【解析】A.反应从开始到8min内A浓度减少了0.64mol/L,故8min内A的反应速率为![]() =
=![]() =0.08 mol/(L•min),随着反应的进行,A的浓度逐渐减少,反应速率逐渐减慢,则第8min末 A的反应速率小于0.08mol·L-1·min-1,故A错误;B.40min时改变的条件是升高温度,且正向为放热反应,故平衡常数会减小,故B错误C.由图像可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C错误;D.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故D正确;故选D。
=0.08 mol/(L•min),随着反应的进行,A的浓度逐渐减少,反应速率逐渐减慢,则第8min末 A的反应速率小于0.08mol·L-1·min-1,故A错误;B.40min时改变的条件是升高温度,且正向为放热反应,故平衡常数会减小,故B错误C.由图像可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C错误;D.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故D正确;故选D。
可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧图乙中阴影部分面积更大。以上所述正确的为( )
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧图乙中阴影部分面积更大。以上所述正确的为( )
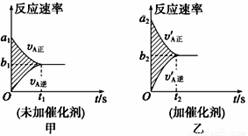
A. ②④⑤⑦ B. ②④⑤⑧ C. ②③⑤⑦ D. ②③⑥⑧
【答案】A

本卷还有22题,登录并加入会员即可免费使用哦~

该作品由: 用户乔分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。