开发新能源是解决环境污染的重要举措,工业上常用CH4和CO2反应制备H2和CO。
(1) 钯的化合物PdCl2通过化学反应可用来检测CO气体,该反应的反应物与生成物有CO、
Pd、H2O、HCl、PdCl2和一种未知物质X,X的化学式为 。
(2) 甲烷经重整催化作用提供反应气的燃料电池如下图所示(以熔融Li2CO3和K2CO3为电解
质)。通入甲烷的电极为 (填“正极”或“负极”),正极的电极反应式
为 ,该电池工作一段时间后,消耗
甲烷3.36 L(标准状况,下同),则B极上消耗空气和二氧化碳混合气体的体积为
L。[已知空气中V(N2)∶V(O2)=4∶1]

(3) CO2通过碳化反应可将钙镁的氢氧化物中的Ca2+、Mg2+分离。化学方程式为
Ca(OH)2+Mg(OH)2+3CO2![]() CaCO3+Mg(HCO3)2+H2O。已知:25 ℃时,CaCO3的Ksp为2.5×10-9,碳
CaCO3+Mg(HCO3)2+H2O。已知:25 ℃时,CaCO3的Ksp为2.5×10-9,碳
 酸钙的溶解度是 g。
酸钙的溶解度是 g。
(4) ①将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反
应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。其他条件相同,在不
2CO(g)+2H2(g)。其他条件相同,在不
同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量
随反应温度的变化如图所示。在a点与b点对应的反应条
件下,反应继续进行一段时间后达到平衡,平衡常数
Ka (填“>”、“<”或“=”)Kb;c点CO含量高于b
点的原因是
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密
闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1。平衡时,根据相关数据绘
制出两条反应速率-浓度关系曲线:v正-c(CH4)和v逆-c(CO)。
 则与曲线v正-c(CH4)相对应的是上图中曲线 (填“甲”或“乙”);该反应
则与曲线v正-c(CH4)相对应的是上图中曲线 (填“甲”或“乙”);该反应
达到平衡后,某一时刻降低温度,反应重新达到平衡,平
衡常数减小,则此时曲线甲对应的平衡点可能为
(填字母,下同),曲线乙对应的平衡点
可能为 。
(1) CO2 (2) 负极 O2+2CO2+4e-![]() 2C 23.52 (3) 5×10-4
2C 23.52 (3) 5×10-4
(4) ①= c点与b点反应均未达到平衡,但c点温度高于b点,反应速率更快,相同时间内生成
CO的量更多,所以c点CO的含量更高 ②乙 E B
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1) CO可用于炼铁,已知:
Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g) ΔH 1=+489.0 kJ· mol-1
2Fe(s)+3CO(g) ΔH 1=+489.0 kJ· mol-1
C(s)+CO2(g)![]() 2CO(g) ΔH 2 =+172.5 kJ· mol-1
2CO(g) ΔH 2 =+172.5 kJ· mol-1
则CO还原Fe2O3(s)的热化学方程式
为 。
(2) 分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负
极反应式:
(3) 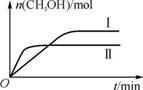 CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时
间的变化如右图。
①由右图判断该反应ΔH 0,曲线Ⅰ、Ⅱ对应的平衡常
数KⅠ KⅡ。(填“>”、“=”或“<”)
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达
到平衡。
| 容器 | 甲 | 乙 |
| 反应物 投入量 | 1 mol CO2、 3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相
等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是
(填字母)。
a. 容器中压强不变 b. H2的体积分数不变 c. c(H2)=3c(CH3OH) d. 容器中密度不变
e. 2个C![]() O键断裂的同时有3个C—H键形成
O键断裂的同时有3个C—H键形成
(4) 将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
二甲醚可用作直接燃料电池,1 mol二甲醚分子经过电化学氧化,可以产生 个电
子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影
响: 。
. (1) Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=-28.5 kJ· mol-1
2Fe(s)+3CO2(g) ΔH=-28.5 kJ· mol-1
(2) CO+4OH-― 2e-![]() C+2H2O (3) ① < > ②0.4<c≤1 ③ab
C+2H2O (3) ① < > ②0.4<c≤1 ③ab
(4) 12NA 该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加,反应速率增
大
研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能
减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2) 已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反
应: CO(g)+H2O(g)![]() H2(g)+CO2(g),500 ℃时的平衡常数为9,若在该温度下进行反应,设
H2(g)+CO2(g),500 ℃时的平衡常数为9,若在该温度下进行反应,设
起始时CO和H2O的浓度均为0.02 mol·L-1,则CO的平衡转化率为 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。


图1 氨气选择性还原NO反应历程 图2 气体中含氮组分浓度随温度变化
①写出总反应的化学方程式: 。
②测得该反应的平衡常数与温度的关系为lg K=5.08+,该反应是 (填“吸热”或
“放热”)反应。
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700 K时,发生副反应的化学
方程式为 。
(4) 图3是用食盐水作电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为N,尾气经氢氧化钠溶液吸收后排入空气。图4是电流密度和溶液pH对烟气脱硝的影响。
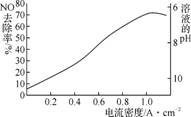
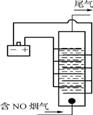
图3 图4 电流密度、pH对NO去除率的影响
①NO被阳极产生的氧化性物质氧化为N反应的离子方程式为
。
②溶液的pH对NO去除率影响的原是 。
③若极板面积为10 cm2,实验烟气含NO 1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,
且烟气中无其他气体被氧化),法拉第常数为96 500 C·mol-1,测得电流密度为1.0 A·cm-2。
列式计算实验中NO去除率: 。
(1) CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ· mol-1
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ· mol-1
(2) 75%
(3) ①4NH3+4NO+O2![]() 4N2+6H2O ②放热 ③4NH3+5O2
4N2+6H2O ②放热 ③4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(4) ①3Cl2+8OH-+2NO![]() 2N+6Cl-+4H2O ②次氯酸钠在酸性条件下氧化性增强
2N+6Cl-+4H2O ②次氯酸钠在酸性条件下氧化性增强
③×100%=73.7%
氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿
色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-572 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-572 kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
H2O(l)![]() H2O(g) ΔH3=+44 kJ·mol-1
H2O(g) ΔH3=+44 kJ·mol-1
写出甲烷将NO2还原为N2并生成液态水时的热化学方程
式: 。
(2) 工业上利用CO2生产甲醇燃料,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·
mol-1。

将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间
变化如下图实线所示(图中字母后的数字表示对应坐标)。
①该反应在08 min内CO2的平均反应速率为 。
②列式计算此温度下该反应的平衡常数: 。
③第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则
v正 (填“大于”、“小于”或“等于”)v逆。
④仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ
改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。
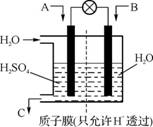
(3) 采用右图装置将SO2转化为重要化工原料。若A为SO2,B为O2,
则A为 极,该极电极反应式
为 。
(4)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,欲用1 L
Na2CO3溶液将0.01 mol BaSO4转化为BaCO3,则
c(Na2CO3)≥ 。
(1) CH4(g)+2NO2(g)![]() N2 (g)+CO2(g)+2H2O(l) ΔH=-954 kJ·mol-1
N2 (g)+CO2(g)+2H2O(l) ΔH=-954 kJ·mol-1
(2) ①0.125 mol·L-1·min- ②K===0.5 ③小于 ④升温 加压
(3) 负 SO2-2e-+2H2O![]() 4H++S (4) 0.25 mol·L-1
4H++S (4) 0.25 mol·L-1
 2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环
2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环
境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1) 机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂,利用汽油中挥发
出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程
式: 。
(2) 我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在
O2/CO2的气氛下燃烧能够降低燃煤时NO的排放,主要反应如下:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若 ①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②CO(g)![]() C(s)+O2(g) ΔH2=+110.5 kJ·mol-1
C(s)+O2(g) ΔH2=+110.5 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH = kJ·mol-1。
(3) 燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为47时电解,硫元素在铅阴极
上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以
及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极反应
式: 。
 (4) SO2经过净化后与空气混合进行催化氧化后制取硫酸
(4) SO2经过净化后与空气混合进行催化氧化后制取硫酸
或者硫酸铵,其中SO2发生催化氧化的反应为
2SO2(g) +O2(g)![]() 2SO3(g)。若在T1 ℃、0.1 MPa条
2SO3(g)。若在T1 ℃、0.1 MPa条
件下,往一密闭容器通入SO2和O2
[其中n(SO2)∶n(O2)=2∶1],测得容器内总压强与反
应时间如右上图所示。
①该反应的化学平衡常数表达式:K= 。
②图中A点时,SO2的转化率为 。
③计算SO2催化氧化反应在图中B点的压强平衡常数
Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④若在T2 ℃、其他条件不变的情况下测得压强的变化曲线如上图所示,则T1 (填
“>”、“<”或“=”)T2;其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小
关系为vC(正) (填“>”、“<”或“=”)vA(逆)。
(1) 2C3H6+18NO![]() 6CO2+6H2O+9N2 (2) -746.5
6CO2+6H2O+9N2 (2) -746.5
(3) 2HS+ 2H++2e-![]() S2+2H2O (4) ① ②45% ③24 300 (MPa)-1 ④< >
S2+2H2O (4) ① ②45% ③24 300 (MPa)-1 ④< >
本卷还有13题,登录并加入会员即可免费使用哦~

该作品由: 用户金奇分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。