下图所示A~E为实验室常见的装置(部分夹持装置略去),请根据要求回答问题。
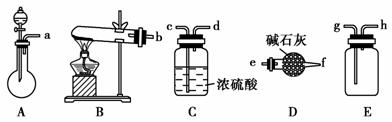
(1)如何检验装置A的气密性:________________________________________________
________________________________________________________________________。
(2)①实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,则需选用上述装置中的
_______________________________(填装置序号)。
②若要制取并收集干燥的CO2,则选用的装置连接顺序为( )→( )→( )→ ( )。(填所选
仪器接口字母)
(3)若在A的分液漏斗内加浓氨水,圆底烧瓶内加NaOH固体,也能制取氨气。请解释装置A中能
产生氨气的原因:______________________________________________________
(4)干燥的氨气在高温下能被CuO氧化成N2,同时CuO转化为Cu,反应的化学方程式是
________________________________________________________________。
其中氧化剂是__________(写化学式,下同),氧化产物是__________。
(5)向浓CaCl2溶液中通入NH3和CO2可以制备碳酸钙,应先通入的气体是__________。写出制备碳
酸钙的化学方程式:______________________________________。
答案: (1)将装置A导管末端密封后,在装置A的分液漏斗内装一定量的蒸馏水,然后打开分液漏斗活塞,若水不能顺利流下,则气密性良好(合理描述均可)
(2)①BDE ②a c d g
(3)氢氧化钠溶于水放出大量热量,体系温度升高,氨气的溶解度减小而放出;氢氧化钠吸水,促使氨气放出;氢氧化钠电离出的OH-促使NH3·H2O的电离平衡左移,导致氨气放出( 任写一种,合理即可)
(4)2NH3+3CuO![]() N2+3H2O+3Cu CuO N2
N2+3H2O+3Cu CuO N2
(5)NH3 CaCl2+CO2+2NH3+H2O===CaCO3↓+2NH4Cl
苯甲醇是有微弱芳香气味的无色透明黏稠液体,有极性,低毒,常用作醇类溶剂。实验室可用苯
甲醛制备苯甲醇,其反应原理为
![]()
 可能用到的有关数据如下:
可能用到的有关数据如下:
| 分子式 | 相对分子质量 | 沸点/℃ | |
| 苯甲醛 | C7H6O | 106 | 178 |
| 苯甲醇 | C7H8O | 108 | 205 |
| 乙醚 | C4H10O | 74 | 34.6 |
反应过程如下:
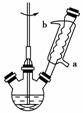
①向如图所示装置中加入适量KOH、水和2.12 g苯甲醛,混匀,加热,使反应充分进行。
②从冷凝管上口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。将乙醚层依次10%
碳酸钾溶液、水洗涤。
③将②中得到的乙醚层倒入盛有少量无水硫酸镁的锥形瓶中,混匀、静置后将其转入蒸馏装置,
缓慢均匀加热,收集203 ℃左右馏分,最后得苯甲醇0.98 g。
回答下列问题:
(1)冷凝管中的冷却水应从________口进________口出。(填“a”或“b”)
(2)步骤②中,最后用水洗涤的作用是__________________________________________。
将分液漏斗中两层液体分离开的实验操作方法是:先___________________,再______________。
(3)步骤③中无水硫酸镁的作用是_______________________________。
(4)步骤③中缓慢均匀加热的目的是____________________________________________
(5)蒸馏过程中不可能使用的仪器有________ ___(填序号)。
A.漏斗 B.蒸馏烧瓶 C.冷凝管 D.牛角管 E.量筒
(6)本实验中苯甲醇的产率为 ________%。(保留一位小数)
答案: (1)a b
(2)除去KOH、苯甲酸钾和碳酸钾等杂质 把下层液体从下端放出 把上层液体从上口倒出
(3)干燥 (4)除去苯甲醇中混有的乙醚 (5)AE (6)90.7
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业上普遍使用Na2SO3与硫黄共
煮制备Na2S2O3,装置如图1。 已知:Na2S2O3在酸性溶液中不能稳定存在。
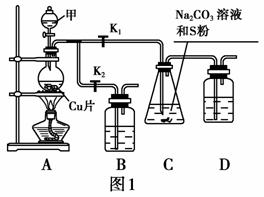
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量试剂甲并加热,则试剂甲为 ________。
步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并
停止加热。必须保持C中溶液呈碱性的原因:若呈酸性,则 、
_(用离子方程式表示)。装置B、D的作用是________________。
步骤3:将C中所得混合物分离提纯后得产品。
(2)利用反应2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2。
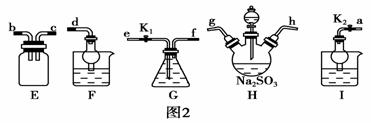
①按气流方向连接各仪器,接口顺序为:____→g,h→____,____→____,____→d。
②装置G盛装的试剂是______________。
(3)Na2S2O3还原性较强,工业上常用来除去溶液中残留的Cl2,该反应的离子方程式为____________________________________________________________________________
(4)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl-:______________ ______________________________________________________________________________________
答案: (1)浓硫酸 CO![]() +2H+===H2O+CO2↑ S2O
+2H+===H2O+CO2↑ S2O![]() +2H+===SO2↑+S↓+H2O 吸收SO2,防止污染
+2H+===SO2↑+S↓+H2O 吸收SO2,防止污染
(2)①a b c e f ②Na2CO3和Na2S的混合溶液
(3)S2O![]() +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO![]() +8Cl-+10H+
+8Cl-+10H+
(4)取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原成了Cl-
某校化学兴趣小组为探究二氧化氮的氧化性和还原性,设计了如下装置图:
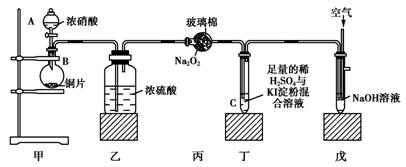
已知:2NO2+2NaOH===NaNO2+NaNO3+H2O
NO2+NO+2NaOH===2NaNO2+H2O
请回答下列问题:
(1)盛放浓硝酸的装置的名称是 ______________________________________。
(2)装置乙的作用是_______________________________________。
(3)装置丙中的实验现象为淡黄色固体变为白色,其反应为Na2O2+2NO2===2NaNO3,该实验证明
NO2具有____________________性。
(4)装置丁可证明NO2具有氧化性,其实验现象为______________,反应的化学方程式为
________________________________________________________________________。
(5)装置戊中通入空气的目的是____________________________________________。
(6)Cu(NO3)2稀溶液呈蓝色,某同学认为装置甲的B中反应后所得溶液呈绿色是由生成的红棕色NO2
溶解于溶液中引起的,请设计一个简单的实验验证其正确性:
________________________________________________________________________。
答案: (1)分液漏斗
(2)除去生成的NO2中含有的水蒸气 (3)还原
(4)溶液变蓝 NO2+2KI+H2SO4===K2SO4+I2+NO+H2O
(5)将NO转化为NO2,被NaOH溶液吸收,防止污染环境
(6)将绿色溶液加水稀释,得到蓝色溶液[或往显蓝色的Cu(NO3)2溶液中通入NO2,合理即可]
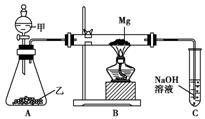
已知Mg能在CO2中燃烧生成MgO和C,某化学兴趣小组的同学为了探究镁在SO2中燃烧的产
 物,进行了如下实验。
物,进行了如下实验。
(1)用如图所示装置进行Mg和SO2反应的实验。
①选择制取SO2的合适试剂是________。
A.10%的H2SO4溶液 B.80%的H2SO4溶液
C.Na2SO3固体 D.CaSO3固体
②装置C中NaOH溶液的作用是______________________________________
③你认为上述装置________(填“有”或“没有”)不足之处。如果有,请说明理由:
________________________________________________________________________。
(2)确定燃烧产物的成分
①收集所得燃烧产物于试管中,加入过量的稀硫酸,发现试管中有气泡冒出,并伴有臭鸡蛋气味,
可能的原因是__________________________________________________。
②将①中反应后的产物进行过滤后,用下图装置进行实验,将滤渣置于试管d中,滴入浓硫酸、
加热,将产物依次通过品红溶液和酸性高锰酸钾溶液。
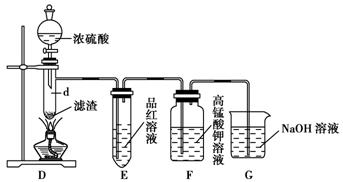
观察到试管E中品红溶液褪色,F中酸性高锰酸钾溶液褪色。化学兴趣小组的同学根据上述现象,得出结论:滤渣和浓硫酸在加热条件下反应,产生SO2。
请你根据上述实验的结果,写出镁在SO2中燃烧的产物__________。写出滤渣与浓硫酸反应的化学方程式____________________________________________________。
案: (1)①BC ②吸收多余的SO2,防止污染环境
③有 在A和B之间未连接干燥装置;未设计防倒吸装置(答出一点即可)
(2)①燃烧产物中有MgS,MgS与稀硫酸反应产生H2S
②MgS、S、MgO S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
本卷还有4题,登录并加入会员即可免费使用哦~

该作品由: 用户xinghua分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。