实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
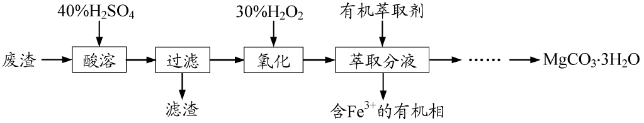
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快酸溶速率;避免制备MgCO3时消耗更多的碱
(2)H2O2+2Fe2++2H+=2Fe3++2H2O (3)①分液漏斗;②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向
上层清液中滴加Na2CO3溶液,若无沉淀生成,
【解析】

(4)根据氢氧化镁和氢氧化铝沉淀的pH可知,滴加氨水的同时必须控制溶液的pH不能超过8.5,且也不能低于5.0,所以边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成,过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
【考点定位】本题主要是考查物质制备工艺流程图分析,涉及反应条件控制、仪器识别、氧化还原反应方程式书写、物质的分离与提纯等化学实验基本操作
【名师点晴】分离提纯型探究实验评价题一般以物质的制备、分离、提纯为基础,考查基本的实验原理、实验方法和实验基本操作。在解题过程中需要注意题目提供信息的应用,特别是新物质的制备过程中,有一些特殊的性质(如易水解、熔沸点等),要善于联系课本相关的物质的性质和实验方法运用于解题。在复习备考中要对元素及化合物的性质进行梳理,从理论的角度进行升入分析,迁移和应用,要重视物质的性质,实验基本操作,物质的分离提纯。电化学类试题具有很强的规律性和策略性,在解题过程中需要不断总结,归纳。工艺流程中的实验分析:工艺流程的命题来源很广,与各个知识模块的结合点较多,因此分析工业生产工艺流程题时,应将流程路线,试题设问和理论知识有机结合起来,它常常结合工艺流程考查基本化学实验问题,可以说它是无机框图题的创新。流程的呈现形式有:①操作流程;②物质变化流程;③装置流程。解题时首先要明确原料和产品(包括副产品),即箭头进出方向,其次依据流程图分析反应原理,紧扣信息,搞清流程中每一步发生了什么反应——知其然,弄清有关反应原理,明确目的(如沉淀反应、除杂、分离)——知其所以然,最后联系储存的知识,有效地进行信息的利用,准确表述和工整书写。由于工艺流程常与溶液的配制、物质的分离及定量测定等基本操作有机结合起来,所以只有复习时牢固掌握实验基础知识,才能有效结合题中的信息,准确答题。
物质制备化工生产流程的主线一般为 。
。
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3=Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
【答案】(1)2SO2+CO32-+H2O=2HSO3-+CO2 (2)防止倒吸 (3)①抽滤瓶;
②减少Na2S2O5的在水中的溶解;
(4)在制备过程中Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。
【解析】
试题分析:(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,根据原子守恒、电荷守恒,可得反应的离子方程式为2SO2+CO32-+H2O=2HSO3-+CO2;
(2)在装置X中用来发生反应制取Na2S2O5;由于SO2是大气污染物, 因此最后的Z装置的NaOH溶液是尾气处理装置,防止SO2造成大气污染。由于二氧化硫易溶于水,因此装置Y的作用防止倒吸。
②制取得到的Na2S2O5固体依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是减少Na2S2O5的在水中的溶解;
(4)实验制得的Na2S2O5固体中常含有一定量的Na2SO3 和Na2SO4,可能的原因是在制备过程中Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。
【考点定位】本题主要是考查物质制备实验方案设计与评价
【名师点晴】明确物质的性质和实验原理是解答的关键,过量试题需要注意以下知识点:第一解答综合性实验设计与评价题的基本流程:原理→反应物质→仪器装置→现象→结论→作用意义→联想。具体分析为:(1)实验是根据什么性质和原理设计的?实验的目的是什么?(2)所用各物质名称、状态、代替物(根据实验目的和相关的化学反应原理,进行全面的分析比较和推理,并合理选择)。(3)有关装置:性能、使用方法、适用范围、注意问题、是否有替代装置可用、仪器规格等。(4)有关操作:技能、操作顺序、注意事项或操作错误的后果。(5)实验现象:自下而上,自左而右全面观察。(6)实验结论:直接结论或导出结论。第二实验方案的设计要点及评价角度:(1)设计要点:实验方案的设计要明确以下要点:①题目有无特殊要求 ②题给的药品、装置的数量 ③注意实验过程中的安全性操作 ④会画简单的实验装置图 ⑤注意仪器的规格 ⑥要防倒吸、防爆炸、防燃烧、防暴沸、防氧化、防吸水、冷凝、冷却、水浴加热时采取相应措施 ⑦同一仪器在不同位置的相应作用等 ⑧要严格按照“操作(实验步骤)+现象+结论”的格式叙述。(2)评价角度:①操作可行性评价:实验原理是否科学、合理,操作是否简单、可行,基本仪器的使用、基本操作是否正确。②经济效益评价:原料是否廉价、转化率是否高,产物产率是否高。③环保评价:原料是否对环境有污染,产物是否对环境有污染,污染物是否进行无毒、无污染处理。
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
【答案】(1)增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。(合理即给分)
浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。
(2)中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解
(3)振荡、静置
(4)原料损失较大、易发生副反应 乙醚;蒸馏
【解析】

(3)乙酸乙酯不溶于水,因此反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液即可。
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应。由于乙醇溶液发生分子间脱水生成乙醚,所以由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,乙醚和乙酸乙酯的沸点相差较大,则分离乙酸乙酯与该杂质的方法是蒸馏。
【考点定位】考查乙酸乙酯制备实验设计。
【名师点睛】乙酸乙酯的制取是中学化学中典型的有机物制备实验之一,有机化学实验中的知识点比较琐碎,特别是许多细节更应引起注意。比如:①加热的方式不同,可有酒精灯直接加热、水浴加热、需用温度计测温度的有机实验等,要知道各种加热方式的优缺点;②许多有机反应都需要催化剂,催化剂种类繁多,要明确实验中所加各物质的作用;③副反应多,相同的反应物在不同的反应条件下可发生不同的化学反应,从而导致产物的不纯;④需要冷却装置的多,由于反应物或产物多为挥发性物质,所以注意对挥发出的反应物或产物进行冷却,以提高反应物的转化率或生成物的产率。水冷或空气冷却是常见的两种方式;⑤产物的分离和提纯,要结合副反应和反应物的挥发性,确定产物中的杂质种类,从而确定分离提纯的方法。⑥结合可逆反应分析反应物的用量。
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_________,由此可知草酸晶体分解的产物中有_______。装置B的主要作用是________。

(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
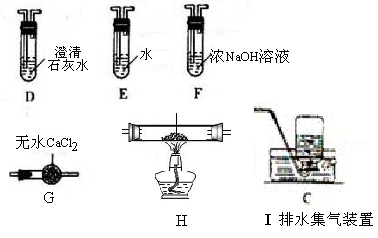
①乙组同学的实验装置中,依次连接的合理顺序为A、B、______。装置H反应管中盛有的物质是_______。
②能证明草酸晶体分解产物中有CO的现象是_______。
(3)设计实验证明:
①草酸的酸性比碳酸的强______。
②草酸为二元酸______。
【答案】(1)有气泡逸出,澄清石灰水变浑浊;CO2;冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验。
(2) ①F、D、G、H、D、I; CuO(氧化铜);
②H中的粉末有黑色变为红色,其后的D中的石灰水变浑浊;
(3) ① 向盛有少量NaHCO3溶液的试管中滴加草酸溶液,有气泡产生。
②用氢氧化钠标准溶液滴定草酸溶液,消耗氢氧化钠的物质的量是草酸的两倍

(2) 问考查实验原理和物质性质综合应用能力。由装置A、B出来的气体含有CO2、CO,容易想到用灼热氧化铜来氧化CO,进而检验其产物CO2。但要注意到原产物中有CO2,故要设计除去CO2和验证CO2除尽的环节。最终确认连接顺序F(除CO2)、D(验证CO2被除尽)、G(干燥,这是气体进入加热装置的常规要求)、H(氧化CO)、D(验证H中生成的CO2来证明CO的存在)、I(尾气处理);H中要装CuO(氧化铜);
(3)问考查实验设计能力,证明“草酸的酸性比碳酸强”这个命题很常规。设计一个常量浓度的溶液混合,产生气泡即可。题中不给试剂浓度的话,浓度大小可不强调。碳酸盐也可以是Na2CO3,但最好不用CaCO3(题目开始部分又暗示CaC2O4难溶)。
证明“草酸是二元酸”这个难一点,要用到中和滴定。用一元强碱NaOH中和,根据酸碱完全反应时的物质的量之比来作判断,这是草酸是二元酸的最可靠的证据。
【考点定位】CO、CO2的性质;化学实验基本知识;化学实验知识的简单应用。难度为较难等级
![]() 【名师点晴】相信每个考生看到这道高考题的第一感都是:题目情景绝对的新颖! 这个实验是我没有做过的!其实破题的关键是要分析出草酸分解的产物,那个反应(H2C2O4·2H2O === CO2↑+CO↑+3 H2O )高中化学里并不常见,我们要学会从题文中捕捉信息来猜想关键产物(CO2来自澄清石灰水的联想,CO来自第二小问),进而用氧化还原反应原理(化合价升降)来验证。知道发生装置中产生的气体是CO2、CO、H2O(g)、少量草酸蒸气(由“受热脱水、升华”这句联想),后续的实验分析和设计大家基本就会了,一道刚刚谋面的新题就变成你的常规题了。可以看出:对你所研究体系的成分进行仔细分析,是好多难题的突破良方。
【名师点晴】相信每个考生看到这道高考题的第一感都是:题目情景绝对的新颖! 这个实验是我没有做过的!其实破题的关键是要分析出草酸分解的产物,那个反应(H2C2O4·2H2O === CO2↑+CO↑+3 H2O )高中化学里并不常见,我们要学会从题文中捕捉信息来猜想关键产物(CO2来自澄清石灰水的联想,CO来自第二小问),进而用氧化还原反应原理(化合价升降)来验证。知道发生装置中产生的气体是CO2、CO、H2O(g)、少量草酸蒸气(由“受热脱水、升华”这句联想),后续的实验分析和设计大家基本就会了,一道刚刚谋面的新题就变成你的常规题了。可以看出:对你所研究体系的成分进行仔细分析,是好多难题的突破良方。
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 C.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
 Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液
(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫
代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【答案】(1) 2:1 (2)①NH4Cl+2HCl![]() 3H2↑+NCl3 ②Cl—、OH— ③c
3H2↑+NCl3 ②Cl—、OH— ③c
(3)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O ②吸收残余的二氧化氯气体(避免碘的逸出)
③淀粉溶液;溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 ④0.02700 (4)d
【解析】(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,在反应中氯元素的化合价从+5价降低到+4价,得到1个电子,氯酸钾是氧化剂。S元素的化合价从+4价升高到+6价,失去2个电子,亚硫酸钠是还原剂,则根据电子得失守恒可知该反应中氧化剂与还原剂物质的量之比为2:1。

(3)①ClO2具有强氧化性,通入锥形瓶与酸性碘化钾溶液反应,氧化I—为I2,自身被还原为Cl—,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O。
②由于二氧化氯是气体,容易挥发到空气中,所以玻璃液封装置的作用是吸收残余的二氧化氯气体。
③由于碘遇淀粉显蓝色,则V中加入的指示剂通常为淀粉,滴定至终点的现象是溶液由蓝色变为无色且半分钟内不变色。
④根据方程式可知2ClO2~5I2~10S2O32-,则测得混合气中ClO2的质量为0.1mol/L×0.02L×67.5g/mol/5=0.02700 g。
(4)亚氯酸盐具有氧化性,明矾不能被氧化,碘化钾被氧化为碘,盐酸可能被氧化氯气,因此若要除去超标的亚氯酸盐,最适宜的是硫酸亚铁,且产生的氧化产物铁离子能净水。
【考点定位】本题考查阅读题目获取信息能力、氧化还原反应滴定及应用、电解原理、对工艺流程及装置理解分析等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握。
【名师点晴】本题从知识上考查了重要物质的化学性质、化学实验基本操作、实验现象的判断与分析、化学探究实验方案的设计与评价、化学方程式的书写、氧化还原反应原理等知识。考查了学生对基础知识的记忆、理解和运用,运用所学知识分析具体问题的能力。也涉及到运用所学知识分析问题、解决问题的能力,同时把元素化合物、基本化学原理和化学实验联系在一起,充分体现了学生对基础知识的掌握和分析问题、解决问题的思维能力,凸显了理科综合考试中的综合性与实用性的特点。
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户lu分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。