右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是 ( )
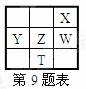
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
【答案】D

【考点定位】本题主要是考查位置、结构与性质、元素周期表与元素周期律,涉及O、S、Si、P、As等五种元素。考查的知识点有原子半径半径、氢化物稳定性、S的存在、晶体类型及作用力、氧化还原反应、元素周期表的应用等
【名师点晴】高考要求学生熟练掌握同一周期、同一主族的原子结构和元素性质的递变规律,了解元素原子结构、在周期表中的位置、性质及其它们之间的关系。高考命题中常将将元素周期表、元素周期律、与元素性质结合进行考察,有时还会结合相应物质的性质和制备进行考查,该种题型是高考经典和必考题型。通过元素周期表考查元素性质(主要包含元素主要化合价、元素金属性非金属性、原子或离子半径等),充分体现了化学周期表中位置反映结构、结构决定性质这一基本原理,更突显了化学学科规律的特色。
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是 ( )
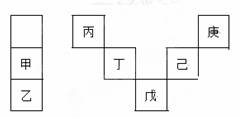
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
【答案】AD
 【考点定位】本题主要考查元素周期报和元素周期律的应用,光导纤维的主要成分。
【考点定位】本题主要考查元素周期报和元素周期律的应用,光导纤维的主要成分。
【名师点睛】在解决有关元素周期表和元素周期律的问题时要具备一些基础知识:1、元素周期表的基本结构,多少个主族,多少个周期,每一周期有多少种元素等。2、必须记得前三周期的元素。3、前三周期元素的化合价、原子半径大小规律。4、同周期、同主族元素性质的递变规律。5、金属性、非金属性强弱的比较。6、离子半径的大小比较。
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是 ( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
【答案】B
 【考点定位】考查元素简单推断、非金属性的判据、无机物结构与性质的简单判断;难度为较难等级。
【考点定位】考查元素简单推断、非金属性的判据、无机物结构与性质的简单判断;难度为较难等级。
【名师点睛】元素周期表是学习化学的工具,元素周期律是化学学习的重要规律。利用元素周期表、元素周期律,结合元素的位、构、性三者的密切关系进行元素推断是化学重要的知识。元素原子的核外电子层数是元素在周期表的周期数,最外层电子数是元素原子所在的主族序数,同一周期随着元素原子序数的增大,原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族的元素从上到下,原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。掌握元素的金属性、非金属性强弱比较方法,结合元素所在的族序数与元素化合价的关系进行判断,确定其正确性。
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是 ( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
【答案】B
【解析】原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,即分别属于第IA、ⅥA ⅦA、IA族。a-的电子层结构与氦相同,则a是H。b和c的次外层有8个电子,即二者均是第三周期元素,所以b是S,c是Cl。c-和d+的电子层结构相同,都是18电子微粒,则d是K。A.同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则元素的非金属性次序为c>b>a,A正确;B.氢元素与硫元素和氯元素分别可以形成共价化合物H2S和HCl,但氢元素与钾元素不能形成共价化合物,而是形成离子化合物KH,B错误;C.d和其他3种元素均能形成离子化合物,即KH、K2S、KCl,C正确;D.氢元素、硫元素和氯元素的最高价、最低价分别是+1和-1、+6或 -2、+7或-1,所以元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6,D正确,答案选B。
【考点定位】本题主要是考查元素推断、元素周期律的应用,涉及非金属性强弱比较、共价化合物和离子化合物判断以及化合价等
【名师点晴】高考要求学生熟练掌握同一周期、同一主族的原子结构和元素性质的递变规律,了解元素原子结构、元素在周期表中的位置、性质及其它们之间的关系。高考命题中常将将元素周期表、元素周期律、与元素性质结合进行考查,有时还会结合相应物质的性质和制备进行考查,该种题型是高考经典和必考题型。通过元素周期表考查元素性质(主要包含元素主要化合价、元素金属性非金属性、原子或离子半径等),充分体现了化学周期表中位置反映结构、结构决定性质这一基本原理,更突显了化学学科规律的特色,题目浓度不大。
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是 ( )
| Y | Z | ||
| X | W |
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
【答案】C

【考点定位】本题通过元素的推断以及元素、物质性质的比较和推测,考查了原子结构、元素周期律及和元素周期表、原子半径大小的比较、离子化合物的判断,以及考生对这些基础知识和规律的应用。
【名师点睛】掌握和理解元素周期表的结构、元素周期律的内容及应用是解答本题的关键,首先根据原子序数的关系和各元素在周期表中的位置推出各元素,然后根据元素周期律推出原子半径的大小关系、气体氢化物的稳定性和最高价氧化物对应水化物的酸性强弱,同时结合离子化合物的含义判断物质的种类,体现了化学理论与元素化合物的联系以及在实践中的应用。
本卷还有40题,登录并加入会员即可免费使用哦~

该作品由: 用户刘岩松分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。