在限定条件下,对各有机物同分异构体数目(不考虑立体异构)的判断中正确的是( )
A B C D
分子式 C4H8 C4H8Cl2 C4H10O C5H10O2
限定条件 能发生加成反应 只有一个甲基 能与钠反应 能溶于水,只有一个官能团
数目 3 5 3 2
A.A B.B C.C D.D
【考点】有机化合物的异构现象.
【专题】同分异构体的类型及其判定.
【分析】A、根据烯烃的同分异构体的书写方法来回答;
B、C4H8Cl2中的碳骨架C﹣C﹣C﹣C和![]()
![]() 两种,根据分子式确定可能有的结构;
两种,根据分子式确定可能有的结构;
C、根据分子式,能和金属钠反应的结构是醇,根据同分异构体的书写方法来判断;
D、C5H10O2能溶于水,只有一个官能团,应该是羧酸类,根据同分异构体的书写方法来判断.
【解答】解:A、C4H8能发生加成反应,该有机物属于烯烃,该烯烃的同分异构体:1﹣丁烯,2﹣丁烯,2﹣甲基﹣1﹣丙烯三种不同的结构,故A正确;
B、C4H8Cl2中的碳骨架C﹣C﹣C﹣C和![]()
![]() 两种,对于C﹣C﹣C﹣C,有三种符合条件的结构,对于
两种,对于C﹣C﹣C﹣C,有三种符合条件的结构,对于![]()
![]() 有1种符合条件的结构,共4种,故B错误;
有1种符合条件的结构,共4种,故B错误;
C、根据分子式,能和金属钠反应的结构是醇,C4H10O属于醇类,它的同分异构体共4种,故C错误;
D、C5H10O2能溶于水,只有一个官能团,应该是羧酸类,同分异构体有4种,故D错误.
故选A.
【点评】本题考查学生有机物的同分异构体的书写方面的知识,注意知识的归纳和梳理是关键,难度中等.
化学与生产、生活、社会密切相关,下列说法中正确的是( )
A.甲烷、乙烯和苯在工业上都可通过石油分馏得到
B.钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.汽油、柴油和植物油都是碳氢化合物
【考点】有机物的结构和性质;金属的电化学腐蚀与防护;常见的生活环境的污染及治理.
【专题】化学应用.
【分析】A.乙烯可通过裂解生成,苯可通过煤的干馏生成;
B.钢铁易发生电化学腐蚀;
C.绿色化学应杜绝污染;
D.植物油为油脂.
【解答】解:A.乙烯通过裂解生成,苯可通过煤的干馏生成,只有甲烷和通过石油分馏生成,故A错误;
B.钢铁在潮湿的空气中易发生电化学腐蚀,故B错误;
C.从源头上消除工业生产对环境的污染是绿色化学的核心,故C正确;
D.植物油为油脂,含有O元素,不是烃类物质,故D错误.
故选C.
【点评】本题综合考查有机物的结构和性质,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.
NA为阿伏伽德罗常数,下列叙述正确的是( )
A.25℃时,1LpH=13的Ba(OH)2溶液中含有的OH﹣数为0.2NA
B.18gD2O中含有的质子数为9NA
C.Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA
D.标准状况下,11.2LCCl4含有的分子数为0.5NA
【考点】阿伏加德罗常数.
【专题】阿伏加德罗常数和阿伏加德罗定律.
【分析】A、pH=13的Ba(OH)2溶液中氢氧根的浓度为0.1mol/L;
B、重水的摩尔质量为20g/mol;
C、铁在氯气中燃烧变为+3价;
D、标况下四氯化碳为液态.
【解答】解:A、pH=13的Ba(OH)2溶液中氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为n=CV=0.1mol/L×1L=0.1mol,故个数为0.1NA个,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为n=![]()
![]() =0.9mol,故含9mol质子即9NA个,故B正确;
=0.9mol,故含9mol质子即9NA个,故B正确;
C、铁在氯气中燃烧变为+3价,故当生成0.5mol产物时,转移1.5mol电子1.5NA个,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
【点评】本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.
从下列实验事实所得出的相应结论正确的是( )
实验事实 结论
① 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2
② 将燃烧的镁条放入CO2中能继续燃烧 还原性:Mg>C
③ NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 酸性:HCO3﹣>Al(OH)3
④ 常温下白磷自燃而氮气在放电时才与氧气反应 非金属性:P>N
⑤ 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 该溶液一定有NH4+
A.①②③ B.①③⑤ C.②③⑤ D.③④⑤
【考点】化学实验方案的评价.
【专题】实验评价题.
【分析】①品红溶液褪色,气体可能具有漂白性或气体与水反应的物质具有漂白性;
②Mg与二氧化碳反应生成MgO和C,Mg元素的化合价升高;
③白色沉淀为氢氧化铝,偏铝酸根离子促进碳酸氢根离子的电离;
④常温下白磷自燃而氮气在放电时才与氧气反应,与物质中的化学键有关,N≡N键能大;
⑤能使湿润红色石蕊试纸变蓝的气体为氨气.
【解答】解:①品红溶液褪色,气体可能具有漂白性或气体与水反应的物质具有漂白性,则气体为SO2、Cl2等,故错误;
②Mg与二氧化碳反应生成MgO和C,Mg元素的化合价升高,Mg作还原剂,还原剂的还原性大于还原产物的还原性,则还原性Mg>C,故正确;
③白色沉淀为氢氧化铝,偏铝酸根离子促进碳酸氢根离子的电离,则酸性:HCO3﹣>Al(OH)3,故正确;
④常温下白磷自燃而氮气在放电时才与氧气反应,与物质中的化学键有关,N≡N键能大,而非金属性N>P,故错误;
⑤能使湿润红色石蕊试纸变蓝的气体为氨气,由操作和现象可知,该溶液一定有NH4+,故正确;
故选C.
【点评】本题考查化学实验方案的评价,为高频考点,涉及气体的性质、氧化还原反应、酸性比较、离子检验等,把握物质的性质及反应原理为解答的关键,侧重分析与应用能力的考查,注意实验的评价性分析,综合性较强,题目难度不大.
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
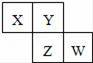

A.原子的半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.氢化物稳定性:X>Y>Z
D.四种元素的单质中,Z单质熔、沸点最高
【考点】位置结构性质的相互关系应用.
【专题】元素周期律与元素周期表专题.
【分析】Y原子的最外层电子数是内层电子数的3倍,Y有2个电子层,最外层电子数为6,Y为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为S元素,W为Cl元素,根据元素所在周期表中的位置,结合元素周期律的递变规律比较原子半径、单质的熔沸点以及最高价氧化物对应水化物的酸性等性质.
【解答】解:Y原子的最外层电子数是内层电子数的3倍,Y有2个电子层,最外层电子数为6,Y为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为S元素,W为Cl元素,
A.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为Z>W>X>Y,故A错误;
B.非金属性W>X>Z,则最高价氧化物对应的水化物的酸性为W>X>Z,故B错误;
C.非金属性Y>X>Z,则氢化物稳定性Y>X>Z,故C错误;
D.氧气、氮气、氯气常温下为气体,Z为S,常温下为固体,熔、沸点最高,故D正确;
故选D.
【点评】本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期律的递变规律.
本卷还有8题,登录并加入会员即可免费使用哦~

该作品由: 用户大漠分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。