信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)铬(24号元素)原子的基态电子排布式为___________。
(2)CH3COCH3分子中含有________个π键,含有____________个σ键。
(3)固态氯化铬酰属于______________晶体,丙酮中碳原子的杂化方式为______________,二硫化碳属于______________(填“极性”或“非极性”)分子,分子中含有____________(填“极性”或“非极性”)键。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有____________键。
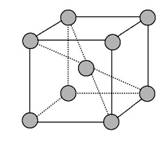
(5)金属铬的晶胞如图所示,一个晶胞中含有_______个铬原子。
【解析】(1)铬为24号元素,属于第4周期第ⅥB族,所以可以很快地写出其基态电子排布式。
(2)CH3COCH3分子结构式为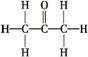 ,羰基中含有1个π键,分子中含有2个C—Cσ键、6个C—Hσ键、1个C—Oσ键。
,羰基中含有1个π键,分子中含有2个C—Cσ键、6个C—Hσ键、1个C—Oσ键。
(3)通过氯化铬酰常温下的熔沸点、溶解性可知其属于分子晶体。丙酮中含有两种碳原子,甲基碳原子杂化方式与甲烷碳原子相同,为sp3杂化;羰基碳原子为sp2杂化。四氯化碳是非极性分子,二硫化碳也是非极性分子,其分子中只含极性键。
(4)K[Cr(C2O4)2(H2O)2]是配位化合物,其中肯定含有配位键。
(5)晶胞中显示的是9个原子,但8个位于晶胞顶点,每个顶点上的原子属于8个晶胞,故属于该晶胞的只有![]() ;晶胞内的原子完全属于该晶胞,因此一个晶胞中含有2个铬原子。
;晶胞内的原子完全属于该晶胞,因此一个晶胞中含有2个铬原子。
答案:(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1)
(2)1 9
(3)分子 甲基碳原子sp3、羰基碳原子sp2 非极性 极性
(4)配位 (5)2
请在标有序号的空白处填空。
(1)可正确表示原子轨道的是____①____。
A.2s B.2d C.3px D.3f
(2)写出基态镓(Ga)原子的电子排布式:____②____。
(3)下列物质变化,只与范德华力有关的是__③____。
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D. 溶于水
溶于水
E.碘溶于四氯化碳
F.石英熔融
(4)下列物质中,只含有极性键的分子是____④____,既含离子键又含共价键的化合物是____⑤____;只存在σ键的分子是____⑥____,同时存在σ键和π键的分子是____⑦____。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6
F.CaCl2 G.NH4Cl
(5)用“>”“ <”或“=”填空:
第一电离能的大小:Mg____⑧____Al;
熔点的高低:KCl____⑨____MgO。
【解析】(1)主量子数为2的能级包括s、p;主量子数为3的能级包括s、p、d;
(2)镓(Ga)的原子序数为31,电子分布的能级为1s、2s、2p、3s、3p、3d、4s、4p。
(3)范德华力存在于分子之间,不含氢键的分子晶体符合题目要求。乙酸、乙醇![]() 、
、![]() 分子间存在氢键,石英为原子晶体,熔融时破坏的是共价键。
分子间存在氢键,石英为原子晶体,熔融时破坏的是共价键。
(4)不同![]() 元素的原子之间形成的共价键为极性键,同种原子之间形成的共价键是非极性键;活
元素的原子之间形成的共价键为极性键,同种原子之间形成的共价键是非极性键;活![]() 泼金属元素和活泼非金属元素形成离子键,铵盐中存在离子键;只形成单键的共价键只存在σ键,含有双键或三键的物质同时存在σ键和π键。故只含有极性键的是CH2Cl2、CO2;既含有离子键又含有共价键
泼金属元素和活泼非金属元素形成离子键,铵盐中存在离子键;只形成单键的共价键只存在σ键,含有双键或三键的物质同时存在σ键和π键。故只含有极性键的是CH2Cl2、CO2;既含有离子键又含有共价键![]() 的化合物是NH4Cl;只存在σ键的分子是CH2Cl2、C2H6;同时存在σ键和π键的分子是N2、CO2、C2H4。
的化合物是NH4Cl;只存在σ键的分子是CH2Cl2、C2H6;同时存在σ键和π键的分子是N2、CO2、C2H4。
(5)同周期从左到右第一电离能增大,但第2、3、4周期中第ⅡA族的第一电离能比相邻的第ⅠA和第ⅢA族的大;KCl与MgO均为离子晶体,晶格能的大小决定熔点高低,KCl与MgO晶胞类型相同,半径r(K+)>r(Mg2+),电荷Mg2+>K+,故MgO的晶格能大于KCl,故熔点KCl<MgO。
答案:①A、C ②1s22s22p63s23p63d104s24p1
③![]() A、E ④B、C ⑤G ⑥C、E ⑦A、B、D
A、E ④B、C ⑤G ⑥C、E ⑦A、B、D
⑧> ⑨<
(1)已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显________价,A的电负性________B的电负性(填“>”“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因____________________________________。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
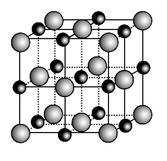
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________________。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有__________个。
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________。
(5)某配合物的分子结构如图所示,其分子内不含有________(填序号)。
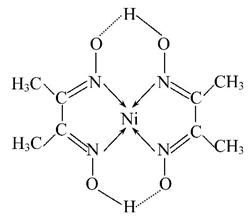
A.离子键 B.极性键 C.金属键 D.配位键
E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。
若有1 mol CH4生成,则有______molσ键和______molπ键断裂。
答案:(1)+3 >
(2)紫外光的光子所具有的能量比蛋白质分子中的化学键C—C、C—N、C—S的键能大,紫外光的光子所具有的能量足以使这些共价键断裂,从而破坏蛋白质分子 sp2、sp3
(3)TiN>MgO>CaO>KCl 12
(4)CrO2 (5)A、C (6)6 2
很多微粒具有六元环的结构。
Ⅰ.六氯环三磷腈分子中包含一个六元环,是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50℃即可升华。在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为3PCl5+3NH4Cl====P3N3Cl6+12HCl。
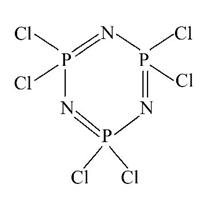
(1)比较磷元素和氯元素的第一电离能:P______Cl(填“>”或“<”)。
(2)在上述反应中断裂的化学键有________(填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键
(3)P3N3Cl6的晶体类型为___________。
Ⅱ.1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:
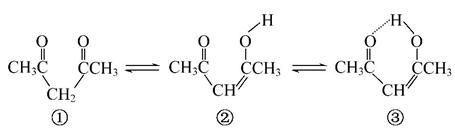
(4)由①转化为②时,π键数目________(填“增加”“减小”或“不变”)。
(5)由②转化为③时,③比②多增加了一种微粒间作用力,该作用力是__________。
Ⅲ.S和Ge可构成[Ge4S10]4-,锗和硫原子也连结成六边形结构,如图所示。
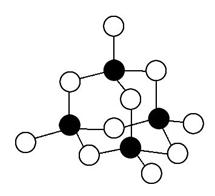
(6)锗原子的价电子排布式为_______。
(7)图中涂黑的微粒代表__________元素。
答案:(1)< (2)A、B、C (3)分子晶体 (4)不变
(5)氢键![]() (6)4s24p2 (7)Ge(或锗)
(6)4s24p2 (7)Ge(或锗)
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②N![]() 的空间构型是______(用文字描述)。
的空间构型是______(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中氧原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
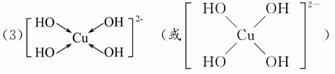
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________。
答案:(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3
③2×6.02×1023个(或2 mol)
本卷还有2题,登录并加入会员即可免费使用哦~

该作品由: 用户杨印分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。