下列溶液中微粒的物质的量浓度关系正确的是( )
A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO)
B.Na2CO3溶液:c(OH-)+c(H+)=c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
答案 D
解析 A项,根据氯元素守恒:2n(Cl2)+n(ClO-)+n(Cl-)+n(HClO)等于通入Cl2的物质的量的2倍;B项,不符合质子守恒;C项,应改为c(HClO)+c(ClO-)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3);D项,当呈中性时,NH
)+c(H2CO3);D项,当呈中性时,NH![]() 和NH3·H2O共同存在,致使c(SO
和NH3·H2O共同存在,致使c(SO![]() )>c(NH
)>c(NH![]() )。
)。
25 ℃时加水稀释10 mL pH=11的氨水,下列叙述正确的是( )
A.原氨水的浓度为10-3 mol·L-1
B.溶液中![]() 增大
增大
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7
答案 B
解析 A项,因NH3·H2O为弱碱,原氨水的浓度应远大于10-3 mol·L-1;B项,加水稀释时,n(NH![]() )增多,n(NH3·H2O)减少,所以
)增多,n(NH3·H2O)减少,所以![]() 增大;C项,加水稀释时,c(NH
增大;C项,加水稀释时,c(NH![]() )、c(NH3·H2O)、c(OH-)均减小,但c(H+)增大;D项,NH3·H2O过量,pH应大于7。
)、c(NH3·H2O)、c(OH-)均减小,但c(H+)增大;D项,NH3·H2O过量,pH应大于7。
下列溶液中微粒的物质的量浓度关系正确的是( )
A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液:c(NH![]() )大小顺序为①>②>③
)大小顺序为①>②>③
B.0.2 mol·L-1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(H+)-c(OH-)=0.1 mol·L-1
C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
答案 B
解析 B项,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(CH3COOH)+c(CH3COO-)=2c(Na+),即:c(CH3COOH)-c(OH-)+c(H+)=c(Na+)=0.1 mol·L-1;C项,由于c(H2CO3)和c(CO![]() )不相等,所以该式不成立;D项,HA-的电离大于水解,所以c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)。
)不相等,所以该式不成立;D项,HA-的电离大于水解,所以c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)。
室温下,将盐酸和氨水等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/mol·L-1 | 反应后溶液的pH | |
| c(氨水) | c(HCl) | ||
| ① | 0.1 | 0.1 | 5 |
| ② | 0.2 | x | 7 |
下列叙述错误的是( )
A.实验②反应后的溶液中:c(NH![]() )+c(NH3·H2O)>0.1 mol·L-1
)+c(NH3·H2O)>0.1 mol·L-1
B.实验①反应后的溶液中c(H+)=c(Cl-)+c(OH-)-c(NH![]() )
)
C.实验①反应后的溶液中:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.实验②反应后的溶液中:c(NH![]() )=c(Cl-)>c(OH-)=c(H+)
)=c(Cl-)>c(OH-)=c(H+)
答案 A
解析 x应小于0.2。A项,根据N元素守恒,c(NH![]() )+c(NH3·H2O)=0.1 mol·L-1;B项,符合电荷守恒。
)+c(NH3·H2O)=0.1 mol·L-1;B项,符合电荷守恒。
25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度叙述正确的是( )
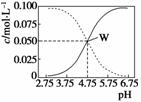
A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH=3.5溶液中:c(Na+)-c(H+)+c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
答案 B
解析 A项,根据图示可以看出pH=5.5时,c(CH3COOH)<c(CH3COO-);B项,根据溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故是正确的;C项,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1,故C是错误的;D项,向W点所表示溶液中通入0.05 mol HCl气体,氯化氢和醋酸钠反应生成醋酸,溶液中电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),故D是错误的。
本卷还有6题,登录并加入会员即可免费使用哦~

该作品由: 用户简睿妮分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。