硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
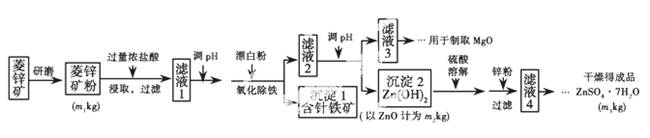
(1)将菱锌矿研磨成粉的目_________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
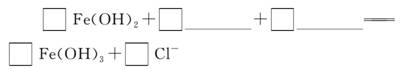
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是____________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________________。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。

氯碱工业是化学工业的基础,如图为一种降低能耗,充分利用氯碱工业产物的联产示意图。
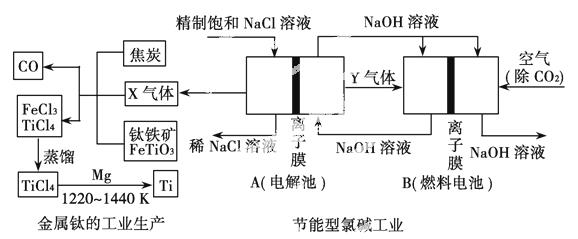
试回答下列问题:
(1)X气体为________(填化学式)。
(2)写出B中燃料电池负极的电极反应式:____________________。
(3)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。将上述处理液加水稀释后, 立即析出大量白色沉淀,写出该反应的离子方程式:_______________。
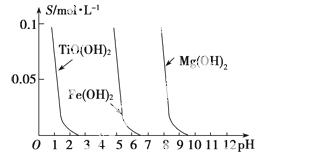
(4)已知:①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641 kJ·mol-1
②![]() Ti(s)+Cl2(g)===
Ti(s)+Cl2(g)===![]() TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:_______________,
该反应过程中还应控制的反应条件是________。

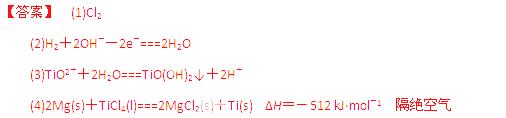
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PF5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。

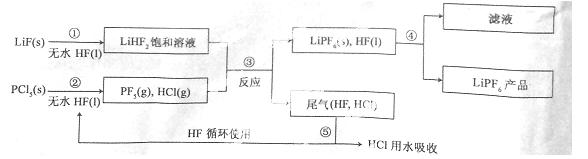
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ∆H=—92.4kJ•mol‾1
2NH3(g) ∆H=—92.4kJ•mol‾1
一种工业合成氨的简易流程图如下:
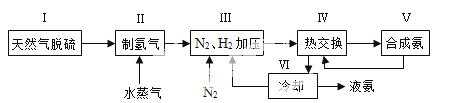
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
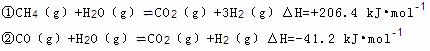
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据![]() 图中a点数据计算N2的平衡体积分数: 。
图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
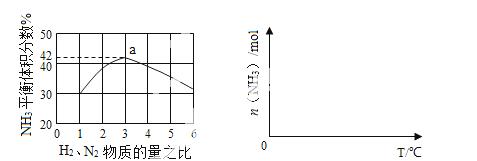
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。

 动,分离液氨,减少生成物浓度,未反应的N2、H2循环使用等措施可提高提高合成氨原料总转化率。
动,分离液氨,减少生成物浓度,未反应的N2、H2循环使用等措施可提高提高合成氨原料总转化率。
【考点定位】本题考查化学反应速率和化学平衡的移动、化学计算、化学图像、化学流程的分析。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
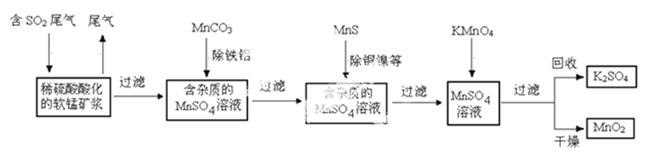
请回答下列![]() 问题:
问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生![]() 成无水MnSO4的热化学方程式是________________。
成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的![]() SO2只与软锰矿浆中的
SO2只与软锰矿浆中的![]() MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、


本卷还有22题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。