含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为__________。
(2)与OH-互为等电子体的一种分子为________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是____________;1 mol乙醛分子中含有的σ键的数目为__________。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____________________________________________________________。
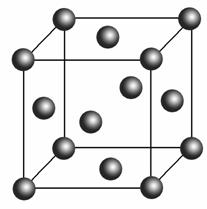
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
解析 (1)Cu的原子序数为29,根据洪特规则特例:能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定,因此Cu原子的基态核外电子排布式为1s22s22p63s23p63d104s1,故Cu+核外基态电子排布式为1s22s22p63s23p63d10。(2)OH-为10电子微粒,电子数相等、原子数相等的微粒之间互为等电子体,故可以是HF。(3)醛基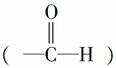 中所有原子在同一平面上,因此中心C原子为sp2杂化;乙醛的结构简式为CH3CHO,CH3CHO中,C—H键是σ键,C===O中,一个键是σ键,另一个键是π键,C—C键是σ健,因此1 mol CH3CHO中有6 mol σ键。(4)CH3CHO被新制Cu(OH)2氧化为CH3COOH,CH3COOH再与NaOH反应生成CH3COONa。(5)根据晶胞可知,铜晶体是面心立方结构,
中所有原子在同一平面上,因此中心C原子为sp2杂化;乙醛的结构简式为CH3CHO,CH3CHO中,C—H键是σ键,C===O中,一个键是σ键,另一个键是π键,C—C键是σ健,因此1 mol CH3CHO中有6 mol σ键。(4)CH3CHO被新制Cu(OH)2氧化为CH3COOH,CH3COOH再与NaOH反应生成CH3COONa。(5)根据晶胞可知,铜晶体是面心立方结构,![]() 顶点离面心的铜原子距离最近,一个晶胞中,一个顶点离它最近的面心铜原子有3个,经过一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共用,故每个铜原子周围距离最近的铜原子有12个。
顶点离面心的铜原子距离最近,一个晶胞中,一个顶点离它最近的面心铜原子有3个,经过一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共用,故每个铜原子周围距离最近的铜原子有12个。
答案 (1)[Ar]3d10或1s22s22p63s23p63d10
(2)HF
(3)sp2 6 NA或6×6.02×1023个
(4)2Cu(OH)2+CH3CH![]() O+NaOH
O+NaOH![]() CH3COONa+Cu2O↓+3H2O (5)12
CH3COONa+Cu2O↓+3H2O (5)12
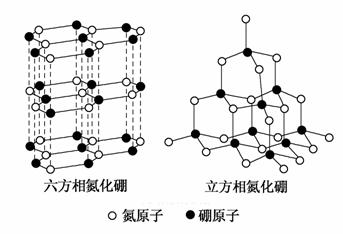
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
(1)基态硼原子的电子排布式为________。
(2)关于这两种晶体的说法,正确的是________(填选项字母)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为__________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是______________________________________________________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
解析 (1)B的原子序数为5,故其基态原子的电子排布式为1s22s22p1。
(2)立方相氮化硼晶体的硬度大小与是否含有σ键和π键无![]() 关,与晶体的结构有关,即立方相氮化硼晶体为原子晶体,硬度较大,a项错误;六
关,与晶体的结构有关,即立方相氮化硼晶体为原子晶体,硬度较大,a项错误;六![]() 方相氮化硼晶体与石墨晶体相似,根据石墨晶体可知其层和层之间是靠范德华力结合的,故其作用力小,质地较软,b项正确;B和N都是非金属元素,两种晶体中的B-N键都是共价键,c项正确;六方相氮化硼晶体与石墨晶体相似,属于混合型晶体,立方相氮化硼晶体为原子晶体,d项错误。
方相氮化硼晶体与石墨晶体相似,根据石墨晶体可知其层和层之间是靠范德华力结合的,故其作用力小,质地较软,b项正确;B和N都是非金属元素,两种晶体中的B-N键都是共价键,c项正确;六方相氮化硼晶体与石墨晶体相似,属于混合型晶体,立方相氮化硼晶体为原子晶体,d项错误。
(3)六方相氮化硼晶体与石墨晶体相似,同一层上的原子在同一平面内,根据六方相氮化硼晶体的晶胞结构可知,1个B原子与3个N原子相连,故为平面三角形结构;由于B最外层有3个电子都参与了成键,层与层之间没有自由移动的电子,故不导电。
(4)立方相氮化硼晶体的结构与金刚石相似,故B原子为sp3杂化;该晶体存在地下约300 km的古地壳中,因此制备需要的条件是高温、高压。
(5)NH![]() 中有1个配位键,BF
中有1个配位键,BF![]() 中有1个配位键,故1 mol NH4BF4含有2 mol配位键。
中有1个配位键,故1 mol NH4BF4含有2 mol配位键。
答案 (1)1s22s22p1
(2)bc
(3)平面三角形 层状结构中没有自由移动的电子
(4)sp3 高温、高压
(5)2
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是________。
(2)XY![]() 离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
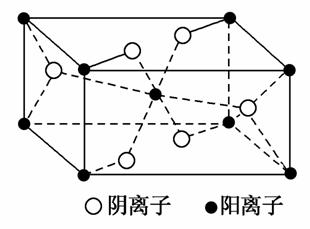
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是_________________________________。
解析 分子式为XY2的红棕色气体为NO2,故X为N元素,Y为O元素,M层与K层电子数相等的基态原子的电子排布式为1s22s22p63s2,则Z为Mg元素,+2价离子的3d轨道上有9个电子的原子的外围电子排布为3d104s1,则R为Cu元素。(1)O元素基态原子的电子排布式为1s22s22p4;第三周期元素中第一电离能最大的主族元素为Cl元素。
(2)NO![]() 与O3为等电子体,两者结构相似,为Ⅴ形;在Cu2+的水合离子中,O原子提供孤电子对,Cu2+提供空轨道。(3)由晶胞结构可看出,阳离子位于顶点和体心,故阳离子个数=
与O3为等电子体,两者结构相似,为Ⅴ形;在Cu2+的水合离子中,O原子提供孤电子对,Cu2+提供空轨道。(3)由晶胞结构可看出,阳离子位于顶点和体心,故阳离子个数=![]() ×8+1=2个,阴离子位于面心和体内,故阴离子个数=
×8+1=2个,阴离子位于面心和体内,故阴离子个数=![]() ×4+2=4个,故阴离子与阳离子个数比为2:1。(4)深蓝色溶液中含有的离子为[Cu(NH3)4]2+,根据得失电子守恒、电荷守恒以及原子守恒可写出离子方程式。
×4+2=4个,故阴离子与阳离子个数比为2:1。(4)深蓝色溶液中含有的离子为[Cu(NH3)4]2+,根据得失电子守恒、电荷守恒以及原子守恒可写出离子方程式。
答案 (1)①1s22s22p4 ②Cl
(2)①Ⅴ形 ②O
(3)2:1
(4)2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++4OH-+6H2O
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为________。
(2)四种元素中第一电离能最小的是________,电负性![]() 最大的是________。(填元素符号)
最大的是________。(填元素符号)
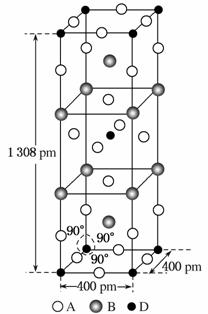
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为________;D的配位数为________;
②列式计算该晶体的密度________g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
解析 由元素C的价电子层中未成对电子数为4知,其不可能位于短周期,结合题意知,元素C位于第四周期,进一步可推出元素A为F,元素B为K,元素C为Fe,元素D为Ni。(2)K原子易失电子,第一电离能最小,F的非金属性最强,电负性最大。(3)根据分摊法,可以求得化合物的化学式为K2NiF4,晶体的密度可由晶胞的质量除以晶胞的体积求得。(4)Fe3+提供空轨道,F-提供孤对电子,两种离子间形成配位键。
答案 (1)
| ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ |
(2)K F
(3)①K2NiF4 6
②![]() =3.4
=3.4
(4)离子键、配位键 [FeF6]3- F-
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______,电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为_____________________________________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
_______________________________________________________。
(6)在硅酸盐中,SiO![]() 四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网
四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网![]() 状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
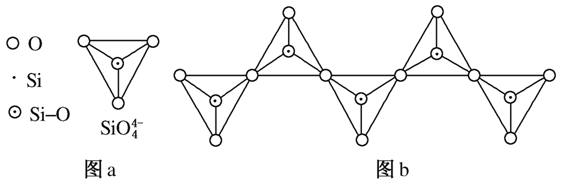
解析 (1)硅的基态原子中,能量最高的能层是第三电子层,符号为M,该能层有9个原子轨道,电子数为4。(2)硅还以SiO2形式存在于地壳中。(3)硅晶体中,硅原子间以共价键结合在一起,其晶胞6个面上各有一个硅原子,依据均摊原则,面心位置贡献3个原子。(4)可先写出:Mg2Si+NH4Cl―→SiH4,由原子守恒知还应该有MgCl2生成,配平镁、氯、硅元素后得Mg2Si+4NH4Cl―→SiH4+2MgCl2,再进一步分析知还应该有NH3生成,最终结果为Mg2Si+4NH4Cl===SiH4+2MgCl2+4NH3。(5)某类物质数量的多少与物质内化学键的稳定性强弱有关,由表中数据知C—C键、C—H键分别比Si—Si键、Si—H键稳定,故烷烃数量较多。同理因键能C—H>C—O、Si—O>Si—H,故SiH4的稳定性小于CH4,更易生成氧化物。(6)因硅与四个氧原子形成四个σ键,故硅原子为sp3杂化。在图a中,硅、氧原子数目比为14,但图b中每个硅氧四面体中有两个氧原子是与其他四面体共用的,故依据均摊原则可确定图b中硅、氧原子数目比为1:3,化学式为(SiO3)![]() 。
。
答案 (1)M 9 4
(2)二氧化硅
(3)共价键 3
(4)Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2
(5)①C—C键![]() 和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1:3 [SiO3]![]() (或SiO
(或SiO![]() )
)
本卷还有2题,登录并加入会员即可免费使用哦~

该作品由: 用户田峰分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。